题目内容
3. 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.I.方案一:沉淀法.利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3).
(1)量取配置好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是Ba(OH)2溶液或Ca(OH)2溶液.
(2)若选用(1)的沉淀剂沉淀后,过滤,洗涤沉淀,判断沉淀是否洗净的方法是取少量最后一次洗涤液,滴加Na2SO4溶液,如无沉淀,则沉淀已洗净,反之则为未完成.
II.方案二:量气法.如图所示,量取配制好的溶液与足量稀硫酸溶液反应,测定生成气体的体积,由此计算混合物中ω(Na2CO3).
(1)装置中导管a的作用是平衡压强、使液体顺利滴下,消除加入稀硫酸引起的气体体积误差.
(2)正确读取气体体积的操作读数前上下移动c,使b、c的液面相平,读数时,视线要和c的凹液面相切.
(3)某同学根据方案二的思路提出方案三:把生成的气体通入足量的生石灰,测定增重的质量,由此计算混合物中ω(Na2CO3),若按此方案,则测得的ω(Na2CO3)偏小(填“偏大”“偏小”或“无影响”).为减小误差,请完善他的方案应先把气体通入浓硫酸后再通入生石灰.
分析 I.方案一:(1)滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,关键是该沉淀剂能够与碳酸氢根离子反应生成沉淀;
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法,根据洗涤液中是否含有钡离子检验;
II.方案二:
(1)由于碳酸盐与酸反应产生二氧化碳气体,瓶内压强增大,所以装置中导管a的作用是平衡压强、使液体顺利滴下;
(2)读数是必须与外界大气压相同,所以注意事项为:①待冷却至室温才开始读数,②读数前左右液面相平;
(3)沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,据此判断对测定结果的影响,应通过浓硫酸干燥吸收水蒸气后,再通入足量的生石灰.
解答 解:I.方案一:(1)Ba(OH)2溶液或Ca(OH)2溶液与HCO3-、CO32-都发生反应生成碳酸钡沉淀,
故答案为:Ba(OH)2溶液或Ca(OH)2溶液;
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法,根据洗涤液中是否含有钡离子检验,取少量最后一次洗涤液,滴加Na2SO4溶液,如无沉淀,则沉淀已洗净,反之则未完成,
故答案为:取少量最后一次洗涤液,滴加Na2SO4溶液,如无沉淀,则沉淀已洗净,反之则未完成;
II.方案二:(1)由于碳酸盐与酸反应产生二氧化碳气体,瓶内压强增大,所以装置中导管a的作用是平衡压强、使液体顺利滴下;消除加入稀硫酸引起的体积误差,
故答案为:平衡压强、使液体顺利滴下,消除加入稀硫酸引起的气体体积误差;
(2)读数是必须与外界大气压相同,所以注意事项为:①待冷却至室温才开始读数,②读数前左右液面相平,还要保证③眼睛视线与液面最低处相平,正确读取气体体积的操作,读数前上下移动c,使b、c的液面相平,读数时,视线要和c的凹液面相切,
故答案为:读数前上下移动c,使b、c的液面相平,读数时,视线要和c的凹液面相切;
(3)把生成的气体通入足量的生石灰,测定增重的质量,由此计算混合物中ω(Na2CO3),沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,所以如果称量值偏大,则碳酸氢钠的质量偏大,则碳酸钠的含量偏小,为减小误差,请完善他的方案应先把气体通入浓硫酸后再通入生石灰,
故答案为:偏小;应先把气体通入浓硫酸后再通入生石灰.
点评 本题考查碳酸钠和碳酸氢钠混合物中碳酸钠含量测定的实验方案设计与评价,题目难度中等,明确化学实验基本操作方法及碳酸钠、碳酸氢钠的性质为解答此题关键,试题充分考查了学生的分析、理解能力及化学实验、化学计算能力.

 阅读快车系列答案
阅读快车系列答案 .
.

 .
. .
. .
. 、
、 .
.
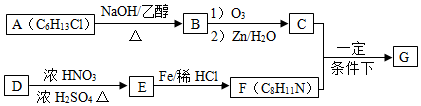
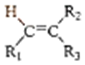 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+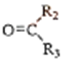
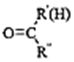 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$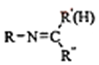 +H2O
+H2O .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).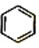 $\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$
$\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$