题目内容
13.Wg镁粉和铝粉的混合物,和过量盐酸反应使金属完全溶解、在加过量的 NaOH反应,然后过滤,将沉淀完全收集后,放坩埚中灼烧,直至物质质量不再变化,取出物质称量仍为wg.求原混合物中铝粉的质量分数约为( )| A. | 40.0% | B. | 58.6% | C. | 60.0% | D. | 47.1% |
分析 wg镁粉和铝粉的混合物,与盐酸反应生成氯化镁和氯化铝,再与过量氢氧化钠溶液反应后得到的沉淀为氢氧化镁,将氢氧化镁加热得到的固体为MgO,取出蒸发皿中的物质称量仍为wg,根据质量守恒定律,铝粉的质量等于MgO中O元素的质量,以此计算原混合物中铝粉的质量分数.
解答 解:wgMg粉和铝粉的混合物,与盐酸反应生成氯化镁和氯化铝,再与过量氢氧化钠溶液反应后得到的沉淀为氢氧化镁,将氢氧化镁加热得到的固体为MgO,取出蒸发皿中的物质称量仍为wg,根据质量守恒定律,原混合物中铝粉的质量等于MgO中O元素的质量,则原混合物中铝粉的质量分数=MgO中氧元素的质量分数=$\frac{16}{40}$×100%=40%,故选A.
点评 本题考查混合物反应的计算,题目难度中等,本题注意分析金属混合物反应前后物质的成分的变化,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
3.下列说法正确的是( )
| A. | 淀粉和纤维素分子式均为(C6H10O5)n,它们水解的最终产物都是葡萄糖,因此淀粉和纤维素互为同分异构体 | |
| B. | 通过蒸馏法、电渗析法、离子交换法等可以实现海水的淡化 | |
| C. | 多糖、蛋白质、油脂均能水解,它们属于天然高分子化合物 | |
| D. | 石油的分馏、煤的干馏、煤的气化和液化均属于物理变化 |
4.能区分胶体和溶液的方法是( )
| A. | 静置,有沉淀现象的是胶体 | B. | 有丁达尔效应的是胶体 | ||
| C. | 能透过滤纸的是溶液 | D. | 用肉眼观察,均一透明的是溶液 |
1.将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)得到如表数据:
求该反应的平衡常数值0.25.
| 温度/℃ | 起始浓度 | 平衡浓度 | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
18.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20 mol PCl3 和0.20molCl2,反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3 和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
5.对A2+3B2?2AB3反应来说,以下反应速率最快的是( )
| A. | V(A2)=0.4 mol•L-1•s-1 | B. | V(B2)=0.6 mol•L-1•s-1 | ||
| C. | V(AB3)=0.5 mol•L-1•s-1 | D. | V(B2)=18 mol•L-1•min-1 |
2.KMnO4是一种重要的氧化剂.
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
□MnO4-+□C2O42-+□16H+═□Mn2++□CO2↑+□8H2O.
(2)某同学为探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下
请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
③用配制好的0.040 0mol•L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
□MnO4-+□C2O42-+□16H+═□Mn2++□CO2↑+□8H2O.
(2)某同学为探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.040 0mol•L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.
8.下列关于卤素的叙述正确的是( )
| A. | 随核电荷数增加卤素原子半径增大 | B. | 随核电荷数增加,单质熔沸点升高 | ||
| C. | 随核电荷数增加,单质氧化性增强 | D. | 随核电荷数增加氢化物越来越稳定 |


 .
. .
. 或
或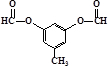 .
. 与G互为同分异构体
与G互为同分异构体