题目内容
制版厂用质量分数为20%(密度为1.119 g.cm-3)的硝酸溶液浸蚀锌板,反应后所得溶液中含硝酸8%,溶液密度为1.068 g.cm-3。求反应后硝酸锌溶液的物质的量浓度(硝酸还原产物是NO)。
答案:
解析:
提示:
解析:
| 溶液中Zn(NO3)2的物质的量浓度为0.72 mol.L-1。
|
提示:
| 设参加反应的锌的物质的量为x,反应前溶液的体积为V1 mL,反应后溶液体积为V2 mL。
依题意:反应过程中溶液质量应增加,而溶液的密度却减小,说明溶液的体积必须增大,有: 3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO↑ + 4H2O △m 3 mol 8×63 g 2×30 g 65×3-2×30=13.5 g x mol (1.119V1×20%-1.06V2×8%)g (1.06V2-1.119V1)g 则又有:
解①,②联立方程组得:
故,所得Zn(NO3)2溶液的物质的量浓度为:
|

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
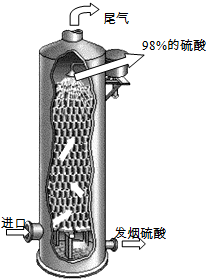 (2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸. 2Fe2O3+8SO2
2Fe2O3+8SO2