题目内容
根据下表提供的数据可知能大量共存的微粒组是
| 化学式 | 电离常数 |
| CH3COOH | K=1.7×10-5 |
| HClO | K=3.0×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
- A.H2CO3、HCO3-、CH3COO-、ClO-
- B.HClO、 HCO3-、CH3COO-、ClO-
- C.HClO 、HCO3-、ClO-、CO32-
- D.HCO3- 、CH3COO-、ClO-、CO32-
由所给电离常数可知,酸性强弱顺序为:CH3COOH>H2CO3>HClO>HCO3-;再依据是“强酸制弱酸”的原理可知:A选项中的H2CO3与ClO-不能大量共存、C项中的HClO与CO32-不可大量共存,故答案为BD

 阅读快车系列答案
阅读快车系列答案下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2OMgCl2+6H2O
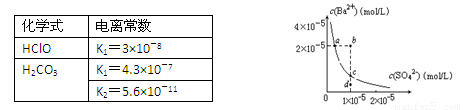
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
| 化学式 | 电离常数 |
| HClO | K1=3×10-8 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。
下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2OMgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
| 化学式 | 电离常数 |
| HClO | K1=3×10-8 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。
下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
|
化学式 |
电离常数 |
|
HClO |
K1=3×10-8 |
|
H2CO3 |
K1=4.3×10-7 |
|
K2=5.6×10-11 |
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。

下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
|
化学式 |
电离常数 |
|
HClO |
K1=3×10-8 |
|
H2CO3 |
K1=4.3×10-7 |
|
K2=5.6×10-11 |
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。

 MgCl2+6H2O
MgCl2+6H2O