题目内容
11. 常温下,用0.1000mol/L 的盐酸滴定0.1000mol/L Na2CO3溶液25.00mL.用pH传感器测得混合溶液的pH变化曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L 的盐酸滴定0.1000mol/L Na2CO3溶液25.00mL.用pH传感器测得混合溶液的pH变化曲线如图.下列说法正确的是( )| A. | c→d发生的主要离子反应:HCO3-+H+═H2O+CO2 | |
| B. | 在b点 时,c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | 在d点 时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 在e点 时完全反应后溶液中水电离出c(H+)=1.0×10-7mol•L-1 |
分析 常温下,用0.1000mol/L 的盐酸滴定0.1000mol/L Na2CO3溶液25.00mL,发生的反应为:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2,结合图象分析,联系溶液中的守恒思想,据此分析判断.
解答 解:常温下,用0.1000mol/L 的盐酸滴定0.1000mol/L Na2CO3溶液25.00mL,发生的反应为:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2,
A.d点时,加入HCl的体积为25mL,此时为第一化学计量点,反应恰好生成HCO3-,则c→d过程中,发生的主要离子反应为:CO32-+H+═HCO3-,故A错误;
B.b点时,加入HCl的体积为12.5mL,此时反应恰好生成起始时c(HCO3-):c(CO32-)=1:1,CO32-的水解程度大于HCO3-的水解程度,则平衡时c(HCO3-)>c(CO32-)>c(OH-),故B正确;
C.d点时,加入HCl的体积为25mL,此时为第一化学计量点,反应恰好生成HCO3-,根据质子守恒:c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故C错误;
D.e点时,加入HCl的体积为50mL,此时为第二化学计量点,反应恰好生成碳酸,为酸性,显然水电离出c(H+)不可能是1.0×10-7mol/L,故D错误.
故选B.
点评 本题考查滴定原理,明确图象上对应点的含义,知道滴定反应,牢牢把握溶液中的守恒思想进行分析,题目难度中等.

练习册系列答案
相关题目
4.下列化学用语不正确的是( )
| A. | NH3分子的结构式: | B. | 乙烯的球棍模型: | ||
| C. | NaCl的电子式: | D. | 中子数为7的碳原子${\;}_{6}^{13}$C |
1.下列说法中不正确的是( )
| A. | 淀粉和纤维素属于多糖类天然高分子化合物,在一定条件下均能水解 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料有固定的熔点 | |
| C. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| D. | “地沟油”经加工处理后,可以用来制肥皂和生物柴油 |
3.下列各类食物中蛋白质含量最丰富的是( )
| A. | 水果类 | B. | 糕点类 | C. | 蛋类 | D. | 蔬菜类 |
1.一定条件下,温度对有机污染物P-CP降解反应的影响如图所示.下列判断不正确的是( )
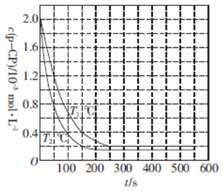

| A. | T1<T2 | |
| B. | p-CP降解反应是吸热反应 | |
| C. | 其他条件相同时,温度越高,反应速率越快 | |
| D. | T1℃时,在50〜150 s之间p-CP的平均降解速率为1.6×10-5 mol•L-1•s-1 |
