题目内容
1.可逆反应 mA(g)+nB(g)?pC(g),在不同温度T、压强p下,生成物C的物质的量分数x(C)的变化情况,如图所示.下列对该反应的判断正确的是( )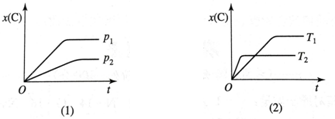
| A. | 吸热反应,m+n<p | B. | 吸热反应,m+n>p | C. | 放热反应,m+n<p | D. | 放热反应,m+n>p |
分析 由达到平衡所用时间可知T2>T1,P1>P2,结合温度、压强的变化对C%的影响可解答该题.
解答 解:由达到平衡所用时间可知T2>T1,P1>P2,升高温度,C的含量降低,说明平衡向逆反应方向移动,则正反应为放热反应;
增大压强,C的含量增大,说明平衡向正反应方向移动,则m+n>p,
故选D.
点评 本题考查化学平衡图象问题,题目难度不大,解答本题的关键是能把握温度、压强的大小,结合对C的含量的影响可解答该题,答题时注意图象曲线的变化趋势.

练习册系列答案
相关题目
9.在C2H2、C6H6、C2H2O2组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数( )
| A. | 92.3% | B. | 87.6% | C. | 75% | D. | 84.9% |
16.下列变化属于吸热反应的是( )
| A. | 将胆矾加热变成白色粉末 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | 干冰升华 | D. | 生石灰与水反应生成熟石灰 |
6.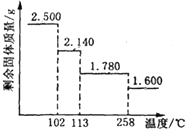 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )| A. | 晶体从常温升至105℃的过程中只有氢键断裂 | |
| B. | 受热过程中,胆矾晶体中形成配位键的4个水分子同时失去 | |
| C. | 120℃时,剩余固体的化学式是CuSO4•H2O | |
| D. | 按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子所处化学环境可以分为3种 |
13.已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中Mg2+浓度为( )
| A. | 1.8×10-7mol•L-1 | B. | 1.0×10-5 mol•L-1 | ||
| C. | 1.0×10-7 mol•L-1 | D. | 1.8×10-9 mol•L-1 |
10.能证明乙醇分子中存在羟基的事实是( )
| A. | 乙醇燃烧有CO2和H2O | B. | 乙醇能够和金属钠反应生成氢气 | ||
| C. | 乙醇能溶于水 | D. | 乙醇能燃烧 |
11.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池的总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中错误的是( )
| A. | 金属锂作电池的负极,石墨作电池的正极 | |
| B. | 电解质溶液中不能混入水,必须与空气隔绝 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出的硫物质的量之比为4:1 |
 和
和
 和
和
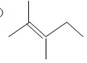
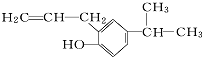 的分子式为C12H16O.
的分子式为C12H16O. 分子中至少有11个碳原子处于同一平面上.
分子中至少有11个碳原子处于同一平面上.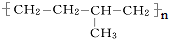 的单体为
的单体为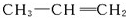 和
和 .
.