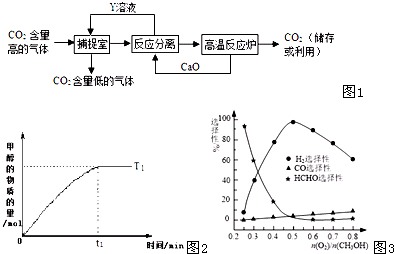
题目内容
A.1mol N2(g)与适量H2(g)起反应,生成2mol NH3(g),放出92.2kJ热量______.
B.1mol N2(g)与适量O2(g)起反应,生成2mol NO2(g),吸收68kJ热量______.
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热______(填“大于”、“等于”或“小于”)192.9kJ/mol.已知水的气化热为44kJ/mol,则氢气燃烧热的热化学方程式为______.
B.1mol N2(g)与适量O2(g)起反应,生成2mol NO2(g),吸收68kJ热量的热化学方程式为N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;
(2)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,而H2O的稳定化合物是液态水,H2O蒸汽转变为液态水需要放热,所以CH3OH的燃烧热大于192.9kJ/mol;
CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol ①
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol ②
②-①得 3H2(g)+3/2O2(g)=3H2O(g)△H=-241.9kJ/mol ③
H2O(l)=H2O(g)△H=+44kJ/mol ④
③-④×3 得 3H2(g)+3/2O2(g)=3H2O(g)△H=-373.9kJ/mol 即H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:大于;H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol.

 阅读快车系列答案
阅读快车系列答案目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程 式_____________________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)  N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
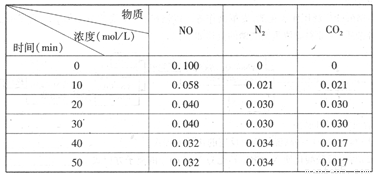
①不能作为判断反应达到化学平衡状态的依据 是_______
A.容器内CO2的浓度保持不变
B.v正(N2)=2 v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在T。C时.该反应的平衡常数为_______(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
2CO+2NO  N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

①上表中:a=_______,b=________,e=________
②请在给出的坐标图中,画出上表中实验II和实验III条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明相应的实验编号