题目内容
4.下列有关物质用途的说法正确的是( )| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 晶体硅可用于制造光导纤维 | D. | 铝制容器可长期存放酸性食物 |
分析 A.胶体具有吸附性而净水;
B、甲醛是有毒的物质,能使蛋白质变性,不能做食品防腐剂;
C、光导纤维的主要成分为二氧化硅;
D、铝是两性元素和酸、碱都发生反应.
解答 解:A.明矾中铝离子易水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物而净水,故A正确;
B、甲醛是有毒气体,不能做食品防腐剂,故B错误;
C、光导纤维是利用光反射原理制成的,二氧化硅具有良好的光导性,光导纤维的主要成分是二氧化硅,故C错误;
D、铝和酸发生反应,不能长期存放酸性食物,故D错误;
故选A.
点评 本题考查了物质的用途,明确物质的性质是解本题关键,根据物质的性质来分析解答即可,性质决定用途,用途体现性质,题目难度不大.

练习册系列答案
相关题目
14.元素周期表中某一区域的一些元素有着某些相似的用途,可以研发新材料或新药物,下列说法可能错误的是( )
| A. | 在金属与非金属分界处寻找半导体材料 | |
| B. | 在周期表的左上方区域开发新核能 | |
| C. | 在右上方活泼非金属区域寻找新药物 | |
| D. | 在过渡元素区域寻找催化剂和耐高温、耐腐蚀的新材料 |
15.下列说法正确的是( )
①S8分子中 S原子采用的轨道杂化方式sp3
②C2H4分子中只有以s轨道与sp2杂化轨道“头碰头”方式重叠而成的σ键
③SnBr2分子中Sn-Br的键角<120°
④H3O+中H-O-H键角比H2O中H-O-H键角大.
①S8分子中 S原子采用的轨道杂化方式sp3
②C2H4分子中只有以s轨道与sp2杂化轨道“头碰头”方式重叠而成的σ键
③SnBr2分子中Sn-Br的键角<120°
④H3O+中H-O-H键角比H2O中H-O-H键角大.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①③④ |
12.下列叙述中,正确的是( )
| A. | 离子化合物中不含共价键 | |
| B. | 共价化合物中不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性键不是化学键 |
19.关于如图所示装置的叙述,错误的是( )


| A. | 锌是负极,其质量逐渐减轻 | |
| B. | 氢离子在铜的表面被还原,产生气泡 | |
| C. | 检流计的指针向右偏转 | |
| D. | 电流从锌片经导线流向铜片 |
3.工业上制取CuCl2的生产流程如图:
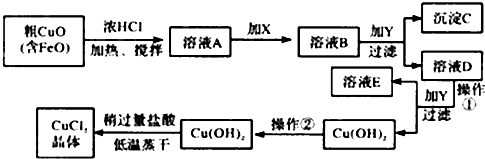
请结合表数据,回答下列问题:
①溶液A中加入X是一种“绿色”氧化剂,则X是NaClO(填化学式),其目的是氧化Fe2+生成Fe3+ 有利于沉淀分离.
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.

请结合表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.
7.一定条件下,在密闭容器中进行可逆反应:N2(g)+3H2(g)?2NH3(g),能说明该反应已达到平衡状态的是( )
| A. | 各物质的质量分数相等 | B. | c(NH3)保持不变 | ||
| C. | 各物质的浓度相等 | D. | c(N2):c(H2):c(NH3)=1:3:2 |