题目内容
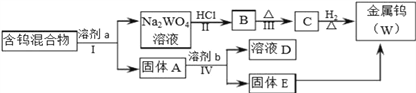
【题目】分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未 检 出 | 未 检 出 |
(1)步骤Ⅰ和Ⅳ均要进行的操作是____________________________________________。
(2)WO3既属于金属氧化物,也属于__________(填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是__________________________________________________。
(3)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是___________________________。
(4)步骤Ⅳ可将W2O5分离出来,选用的试剂b是_______________,固体E中含有的物质是_______________,D中的溶质是_______________。
【答案】 过滤 酸性 WO3+2OH-=WO42-+H2O WO3的浸取率为100%,W2O5的浸取率很低 50g/LNa2CO3 W、WO2 Na2WO4
【解析】(1)经过步骤Ⅰ和Ⅳ后分别得到溶液和不溶固体,故均要进行的操作是过滤。
(2)WO3易溶于NaOH溶液并形成Na2WO4,故WO3属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O。
(3)根据WO3在饱和Na2C2O4(在CO2气氛下浸取)溶液中的浸取率为100%,而其他含W的物质基本上不被浸出,故步骤Ⅰ中要将WO3分离出来,选择的试剂a是饱和Na2C2O4(在CO2气氛下浸取),答案为:WO3的浸取率为100%,W2O5的浸取率很低。
(4)含钨混合物经过饱和Na2C2O4(在CO2气氛下浸取)浸取后,得到固体A的成分为W、WO2和W2O5,步骤Ⅳ要将W2O5分离出来,根据三种物质在不同溶剂中的浸取率可知,当选用的溶剂为50g/LNa2CO3时,W2O5的浸取率为100%,而W、WO2不溶解,故b试剂为50g/LNa2CO3;固体E中含有的物质为W、WO2;W2O5可溶于Na2CO3溶液,并被氧化为Na2WO4,故D中的溶质是Na2WO4。