题目内容
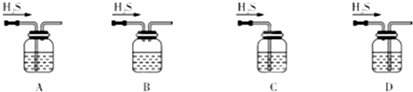
已知H2S溶于水得到氢硫酸.现将一定物质的量的硫化氢气体通入 NaOH 溶液中,经测定所得溶液中的溶质 Na2S和NaHS物质的量之比为3∶2,则参加反应 的H2S 和 NaOH 的物质的量之比为
- A.3∶2
- B.2∶3
- C.8∶5
- D.5∶8
D
解析:H2S+NaOH==NaHS+H2O H2S+2NaOH==Na2S+2H2O 解答本题有多法,其中例证加守恒法最快捷.例证产生Na2S、NaHS各为3mol、2 mol,根据S、Na元素守恒知H2S为(3+2)mol,NaOH为(2×3+2)mol,即5∶8.
解析:H2S+NaOH==NaHS+H2O H2S+2NaOH==Na2S+2H2O 解答本题有多法,其中例证加守恒法最快捷.例证产生Na2S、NaHS各为3mol、2 mol,根据S、Na元素守恒知H2S为(3+2)mol,NaOH为(2×3+2)mol,即5∶8.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目