题目内容
10.如图表示各物质之间的转化关系.已知D、E、Z是中学化学常见的单质,其他都是化合物.Z、Y是氯碱工业的产品.D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂.E为日常生活中应用最广泛的金属.除反应①外,其他反应均在水溶液中进行.请回答下列问题: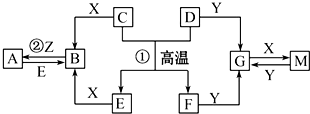
(1)写出下列物质的化学式:BFeCl2、GNaAlO2、YNaOH.
(2)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则E是阴极,请写出在此电极上发生的电极反应式:Cu2++2e-═Cu.
(3)写出反应①的化学方程式3FeO+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Fe.
(4)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp=2.97×10-39.将0.01mol•L-1的A溶液与0.001mol•L-1的NaOH溶液等体积混合,你认为能否形成沉淀能(填“能”或“不能”),请通过计算说明c(Fe3+)•c3(OH-)=($\frac{1}{2}$×0.01)×($\frac{1}{2}$×0.001)3=6.25×10-13>2.097×10-39,能生成Fe(OH)3沉淀.
分析 D、E、Z是中学化学常见的单质,其他都是化合物.Z、Y是氯碱工业的产品.D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂.E为日常生活中应用最广泛的金属.除反应①外,其他反应均在水溶液中进行.结合转化关系可知,反应①为铝热反应,D为Al、E为Fe;再结合反应②可知,C为FeO,X为HCl,Z为Cl2,又由Al及其化合物转化可知,Y为NaOH,则A、B、C、F、G、M分别为FeCl3、FeCl2、FeO、Al2O3、NaAlO2和Al(OH)3(或AlCl3),然后利用元素化合物性质及化学用语来解答.
解答 解:D、E、Z是中学化学常见的单质,其他都是化合物.Z、Y是氯碱工业的产品.D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂.E为日常生活中应用最广泛的金属.除反应①外,其他反应均在水溶液中进行.结合转化关系可知,反应①为铝热反应,D为Al、E为Fe;再结合反应②可知,C为FeO,X为HCl,Z为Cl2,又由Al及其化合物转化可知,Y为NaOH,则A、B、C、F、G、M分别为FeCl3、FeCl2、FeO、Al2O3、NaAlO2和Al(OH)3(或AlCl3),
(1)由上述分析可知,B、G、Y分别为FeCl2、NaAlO2、NaOH,
故答案为:FeCl2;NaAlO2;NaOH;
(2)电镀过程中,镀层金属为阳极,镀件为阴极,金属阳离子在阴极得到电子发生还原反应转化成金属,阴极反应为Cu2++2e-═Cu,
故答案为:阴;Cu2++2e-═Cu;
(3)反应①的化学方程式为3FeO+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Fe,故答案为:3FeO+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Fe;
(4)由Ksp可知,c(Fe3+)•c3(OH-)=($\frac{1}{2}$×0.01)×($\frac{1}{2}$×0.001)3=6.25×10-13>2.097×10-39,能生成Fe(OH)3沉淀,
故答案为:能;c(Fe3+)•c3(OH-)=($\frac{1}{2}$×0.01)×($\frac{1}{2}$×0.001)3=6.25×10-13>2.097×10-39,能生成Fe(OH)3沉淀.
点评 本题考查无机框图推断,为高频考点,题目综合性强,涉及面广,所以要理清思路,可以根据以下步骤分析题目:审题→挖掘、筛选信息→联系已学知识→寻找突破点→推理判断→得出结论→正向求证.找准突破点是解无机框图推断题的关键,也是基本方法,题目难度中等.

| A. | 在晶体中只要有阳离子就一定有阴离子 | |
| B. | .离子晶体中只有离子键没有共价键,分子晶体中只有分子间作用力没有共价键 | |
| C. | .分子晶体中分子间作用力越大,分子越稳定 | |
| D. | .原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | 全部 |
| A. | Na和O2 | B. | NaHCO3和NaOH | C. | NaOH和CO2 | D. | Na2CO3和HCl |
| A. | 不同化学反应的限度都相同 | |
| B. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| C. | 当一个可逆反应在一定条件下达到限度时,反应即停止 | |
| D. | 当一个可逆反应在一定条件下达到限度时,正反应速率与逆反应速率相等 |
| A. | 用氯化钡溶液可区别SO42-和CO32-离子 | |
| B. | 只能用加入试剂的方法区别(NH4)2 SO4和Fe2(SO4)3溶液 | |
| C. | 用丁达尔效应可区别Fe(OH)3胶体和饱和FeCl3溶液 | |
| D. | 用澄清石灰水可区别Na2CO3溶液和NaHCO3溶液 |
 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. .
.
