题目内容
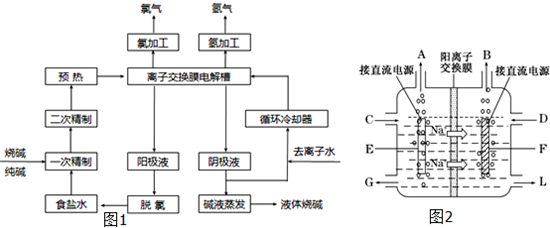
氯碱工业中电解饱和食盐水的原理示意图如图所示:
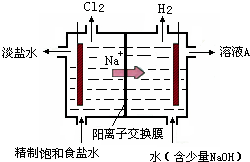
(1)由于生成的氯气可溶于水,并发生下列反应Cl2+H2O?HCl+HClO,电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
(2)电解所用的盐水需精制.去除食盐水中含有的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精致流程如下(淡盐水和溶液A来上述电解池):
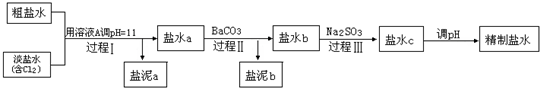
①盐泥a除泥沙外,还含有的物质是
②过程Ⅰ中Cl2将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水c中剩余Na2SO3的含量小于5mg/L,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,最多添加10%Na2SO3溶液的质量为多少kg?(加入溶液引起的体积变化忽略不计,请写出解题步骤).

(1)由于生成的氯气可溶于水,并发生下列反应Cl2+H2O?HCl+HClO,电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出
氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出
;(2)电解所用的盐水需精制.去除食盐水中含有的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精致流程如下(淡盐水和溶液A来上述电解池):

①盐泥a除泥沙外,还含有的物质是
Mg(OH)2
Mg(OH)2
.②过程Ⅰ中Cl2将NH4+转化为N2的离子方程式是
2NH4++3Cl2+8OH-=N2+6Cl-+8H2O或2NH4++3ClO-+2OH-=N2+3Cl-+5H2O
2NH4++3Cl2+8OH-=N2+6Cl-+8H2O或2NH4++3ClO-+2OH-=N2+3Cl-+5H2O
.③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
Ca2+、SO42-
Ca2+、SO42-
.④经过程Ⅲ处理,要求盐水c中剩余Na2SO3的含量小于5mg/L,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,最多添加10%Na2SO3溶液的质量为多少kg?(加入溶液引起的体积变化忽略不计,请写出解题步骤).
1.76kg
1.76kg
.分析:(1)根据阳极产物和平衡移动原理分析;
(2)①根据杂质离子和溶液的酸碱性判断能反应生成的沉淀;
②根据A溶液成分和可能具有的性质,结合氧化还原反应和质量守恒定律书写离子方程式;
③根据溶液成分和溶解度大小判断生成的沉淀;
④根据反应方程式和质量守恒解答.
(2)①根据杂质离子和溶液的酸碱性判断能反应生成的沉淀;
②根据A溶液成分和可能具有的性质,结合氧化还原反应和质量守恒定律书写离子方程式;
③根据溶液成分和溶解度大小判断生成的沉淀;
④根据反应方程式和质量守恒解答.
解答:解:(1)电解饱和食盐水时,阴极反应式为:2H2O-2e-═2OH-+H2↑,阳极反应式为:2Cl--2e-═Cl2↑,阴极产物为NaOH和H2,阳极产物是Cl2,电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O?HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
故答案为:氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出;
(2)①根据粗盐水和淡盐水的化学成分,结合精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2,
故答案为:Mg(OH)2;
②将NH4+转化为N2的氧化剂是Cl2,对应的离子方程式是2NH4++3Cl2+8OH-═N2+6Cl-+8H2O,
故答案为:2NH4++3Cl2+8OH-=N2+6Cl-+8H2O;
③过程II是利用沉淀溶解平衡原理,将溶液中的Ca2+和SO42-分别转化为CaCO3和BaSO4沉淀除去,
故答案为:Ca2+、SO42-;
④处理10m3盐水b中含有NaClO的物质的量为n=
=1mol
根据反应:NaClO+Na2SO3═NaCl+Na2SO4,可知与NaClO完全反应消耗的Na2SO3为1mol,
质量为m=n×M=1mol×126g/mol=126g,
根据题意,设最多添加10%Na2SO3溶液的质量为x
=5mg/L,
解得:x=1760g=1.76kg,
故答案为:1.76kg.
故答案为:氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出;
(2)①根据粗盐水和淡盐水的化学成分,结合精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2,
故答案为:Mg(OH)2;
②将NH4+转化为N2的氧化剂是Cl2,对应的离子方程式是2NH4++3Cl2+8OH-═N2+6Cl-+8H2O,
故答案为:2NH4++3Cl2+8OH-=N2+6Cl-+8H2O;
③过程II是利用沉淀溶解平衡原理,将溶液中的Ca2+和SO42-分别转化为CaCO3和BaSO4沉淀除去,
故答案为:Ca2+、SO42-;
④处理10m3盐水b中含有NaClO的物质的量为n=
| 1000L×10×7.45×10-3g/L |
| 74.5g/mol |
根据反应:NaClO+Na2SO3═NaCl+Na2SO4,可知与NaClO完全反应消耗的Na2SO3为1mol,
质量为m=n×M=1mol×126g/mol=126g,
根据题意,设最多添加10%Na2SO3溶液的质量为x
| (x×10%-126g)×103mg/g |
| 10000L |
解得:x=1760g=1.76kg,
故答案为:1.76kg.
点评:本题考查氯碱工业,注意把握题给信息,掌握电解原理,根据反应方程式和质量守恒进行计算为解答该题的关键,题目难度中等.

练习册系列答案
相关题目
化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是( )
| A、硫酸生产中常采用高压条件提高SO2的转化率 | B、合成氨中采用及时分离氨气提高反应速率 | C、电解精炼铜时,溶液中c(Cu2+)基本保持不变 | D、氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
下列不正确的是( )
| A、用电解法精练粗铜时,粗铜作阳极,纯铜作阴极 | B、锌锰干电池工作时,电池的总反应为:Zn+2MnO2+2NH4+?Zn2++Mn2O3+2NH3+H2O | C、钢铁电化学腐蚀时,负极反应式为:2H2O+O2+4e-?4OH- | D、氯碱工业中电解饱和食盐水,阳极反应式为:2Cl--2e-?Cl2 |
下列关于“氯碱工业”的说法中,正确的是( )
| A、“氯碱工业”的原料是Cl2和烧碱 | B、“氯碱工业”的主要生产过程是电解饱和食盐水 | C、“氯碱工业”的主要产品是纯碱 | D、“氯碱工业”消耗的能源主要是热能 |