题目内容
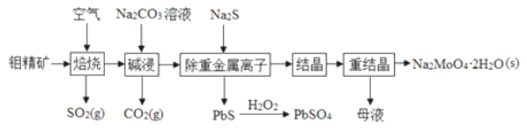
【题目】钼酸钠晶体![]() 是无公害型冷却水系统的金属缓蚀剂,由钼精矿
是无公害型冷却水系统的金属缓蚀剂,由钼精矿![]() 主要成分是
主要成分是![]() ,含少量PbS等
,含少量PbS等![]() 制备钼酸钠晶体的部分流程如图所示
制备钼酸钠晶体的部分流程如图所示
![]() 中钼元素的化合价为__________。
中钼元素的化合价为__________。
![]() 焙烧时为了使钼精矿充分反应,可采取的措施是__________
焙烧时为了使钼精矿充分反应,可采取的措施是__________![]() 答出一条即可
答出一条即可![]() 。
。
![]() 焙烧过程中钼精矿发生的主要反应的化学方程式为
焙烧过程中钼精矿发生的主要反应的化学方程式为![]() 未配平
未配平![]() ,该反应中氧化产物是__________
,该反应中氧化产物是__________![]() 填化学式
填化学式![]() ;当生成
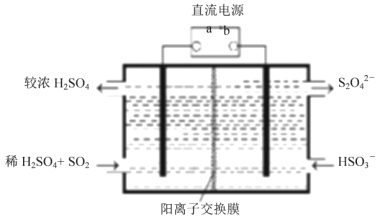
;当生成![]() 时,该反应转移的电子的物质的量为__________mol。利用下图所示装置
时,该反应转移的电子的物质的量为__________mol。利用下图所示装置![]() 电极均为惰性电极
电极均为惰性电极![]() 也可吸收
也可吸收![]() ,并用阴极排出的溶液吸收
,并用阴极排出的溶液吸收![]() 。阳极的电极反应式为__________,在碱性条件下,用阴极排出的溶液吸收
。阳极的电极反应式为__________,在碱性条件下,用阴极排出的溶液吸收![]() ,使其转化为无害气体,同时有
,使其转化为无害气体,同时有![]() 生成,该反应的离子方程式为______。
生成,该反应的离子方程式为______。
![]() 碱浸时,
碱浸时,![]() 与
与![]() 溶液反应的离子方程式为___________。
溶液反应的离子方程式为___________。
![]() 重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______。
重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______。
![]() 过滤后的碱浸液结晶前需加入
过滤后的碱浸液结晶前需加入![]() 固体以除去
固体以除去![]() ,当
,当![]() 开始沉淀时,
开始沉淀时, ![]() 去除率为
去除率为![]() ,已知碱浸液中
,已知碱浸液中![]() ,
,![]() ,
,![]() 、则
、则![]() ___________
___________![]() 加入
加入![]() 固体引起的溶液体积变化可忽略
固体引起的溶液体积变化可忽略![]() 。
。
【答案】![]() 将矿石粉碎
将矿石粉碎![]() 或增加空气的进入量或采用逆流原理等
或增加空气的进入量或采用逆流原理等![]()
![]() 7
7 ![]()
![]()
![]() 使用多次后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度
使用多次后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度 ![]()
【解析】
(1)根据在化合物中正负化合价代数和为零计算;(2)焙烧时为了使钼精矿充分反应可以把钼精矿粉碎增大接触面积、或增大空气进入量,反应物接触时间越长,反应越充分;(3)焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2![]() 2MoO3+4SO2;(4)碱性条件下MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠。
2MoO3+4SO2;(4)碱性条件下MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠。
![]() 计算结晶水合物钼钼酸钠中元素的化合价只计算
计算结晶水合物钼钼酸钠中元素的化合价只计算![]() 中钼元素的化合价即可,钠元素显
中钼元素的化合价即可,钠元素显![]() ,氧元素显
,氧元素显![]() ,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可知钼酸钠
,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可知钼酸钠![]() 中钼元素的化合价:
中钼元素的化合价:![]() ,则
,则![]() ;
;
故答案为:![]() ;
;
![]() 反应物接触时间越长,反应越充分,焙烧的过程中采用“逆流焙烧”的措施、粉碎矿石或增加空气通入量等,增大钼精矿与空气接触,使其充分反应,提高原料的利用率;
反应物接触时间越长,反应越充分,焙烧的过程中采用“逆流焙烧”的措施、粉碎矿石或增加空气通入量等,增大钼精矿与空气接触,使其充分反应,提高原料的利用率;
故答案为:将矿石粉碎![]() 或增加空气的进入量或采用逆流原理等
或增加空气的进入量或采用逆流原理等![]() ;
;
![]() 焙烧过程中钼精矿发生的主要反应的化学方程式为:
焙烧过程中钼精矿发生的主要反应的化学方程式为:![]() ,元素化合价升高的失去电子发生氧化反应得到氧化产物,反应中Mo元素化合价
,元素化合价升高的失去电子发生氧化反应得到氧化产物,反应中Mo元素化合价![]() 价变化为
价变化为![]() 价,硫元素化合价
价,硫元素化合价![]() 价变化为
价变化为![]() 价,该反应中氧化产物是
价,该反应中氧化产物是![]() 、
、![]() ;反应中生成4mol二氧化硫电子转移28mol,则生成1mol二氧化硫电子转移为7mol;由图可知阳极
;反应中生成4mol二氧化硫电子转移28mol,则生成1mol二氧化硫电子转移为7mol;由图可知阳极![]() 被氧化为
被氧化为![]() ,其电极反应式为
,其电极反应式为![]() ;在碱性条件下,用阴极排出的溶液吸收
;在碱性条件下,用阴极排出的溶液吸收![]() ,使其转化为无害气体
,使其转化为无害气体![]() ,同时有
,同时有![]() 生成,该反应的离子方程式为
生成,该反应的离子方程式为![]() ;故答案为:
;故答案为:![]() 、
、![]() ;7;
;7;![]() ;
;![]() ;
;
![]() 碱性条件下,
碱性条件下,![]() 和
和![]() 溶液反应生成二氧化碳和钼酸钠,离子方程式为
溶液反应生成二氧化碳和钼酸钠,离子方程式为![]() ;故答案为:
;故答案为:![]() ;
;
![]() 由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理;故答案为:使用多次后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理;故答案为:使用多次后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
![]() 当
当![]() 开始沉淀时溶液中钡离子浓度
开始沉淀时溶液中钡离子浓度 ,溶液中硫酸根离子浓度
,溶液中硫酸根离子浓度 ,
,![]() 的去除率为
的去除率为![]() ,
, ,
, ;
;![]() ;故答案为:
;故答案为:![]() 。
。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为______(填化学式),V4+﹣O﹣H在反应过程中作___________。当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为____________L。

(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣538kJ·mol﹣1。断开1mol下列化学键系数的能量分别为N﹣H:390kJ、N≡N:946kJ、O﹣H:460kJ、O=O:498kJ。则断开1molN﹣N需要吸收的能量是__________.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①若其它条件不变,则下列图象不正确的是_____(填字母)。
A. B.
B.  C.
C. D.
D.
②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示。
| c(NH3)/mol·L﹣1 | c(O2)/mol·L﹣1 | c(NO)mol·L﹣1 |
0 | 1.2 | 1.75 | 0 |
4min | 0.4 | 0.75 | 0.8 |
6min | 0.4 | 0.75 | 0.8 |
8min | 0.6 | 1 | 0.6 |
9min | 0.6 | 1 | 0.6 |
10min | 1.05 | 1 | 1.05 |
12min | … | … | … |
0~4min内,用O2表示该反应的平均反应速率为______mol·L﹣1·min﹣1。反应6~8min时改变了反应条件,改变的反应条件可能是___________。