题目内容
(1)有机物M经过太阳光照可转化成N,转化过程如下:
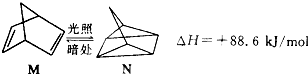
则M、N相比,较稳定的是
(2)已知CH3OH(l)的燃烧热△H=-238.6kJ/mol,CH3OH(l)+
O2(g)═CO2(g)+2H2(g)△H=-akJ/mol
则a
(3)将CH3OH设计成燃料电池,KOH溶液为电解质溶液,则通CH3OH气体的电极为电池的
(4)断裂1mol化学键所需的能量见下表:
常温下,N2与H2O反应生成NH3的热化学方程式为:
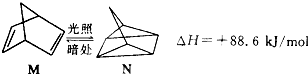
则M、N相比,较稳定的是
M
M
.(2)已知CH3OH(l)的燃烧热△H=-238.6kJ/mol,CH3OH(l)+
| 1 |
| 2 |
则a
<
<
(填“>”、“<”或“=”)238.6.(3)将CH3OH设计成燃料电池,KOH溶液为电解质溶液,则通CH3OH气体的电极为电池的
负
负
极,该电极反应式为CH3OH-6e-+8OH-=C032-+6H2O
CH3OH-6e-+8OH-=C032-+6H2O
.(4)断裂1mol化学键所需的能量见下表:
| 共价键 | H-N | H-O | N≡N | O=O |
| 断裂1mol化学键所需能量/kJ/mol | 393 | 460 | 941 | 499 |
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1189KJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1189KJ/mol
.分析:(1)依据转化过程中M、N的能量高低分析判断,能量越高越活泼;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(3)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂氧气的电极为正极;负极电极反应式为:CH3OH-6e-+8OH-=C032-+6H2O;
(4)依据反应的焓变=反应物键能总和-生成物键能总和,依据热化学方程式的书写方法写出;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(3)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂氧气的电极为正极;负极电极反应式为:CH3OH-6e-+8OH-=C032-+6H2O;
(4)依据反应的焓变=反应物键能总和-生成物键能总和,依据热化学方程式的书写方法写出;
解答:解:(1)转化过程是吸热反应,M的能量低于N,说明M稳定,故答案为:M;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式中生成的氢气不稳定,燃烧会放热,所以a<238.6;
故答案为:<;
(3)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料甲醇的电极为负极,电极反应式为:CH3OH-6e-+8OH-=C032-+6H2O;
故答案为:负,CH3OH-6e-+8OH-=C032-+6H2O;
(4)常温下,N2与H2O反应生成NH3的反应为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),
反应焓变△H=2×941KJ/mol+6×2×460KJ/mol-(4×3×393KJ/mol+3×499KJ/mol)=1189KJ/mol,
热化学方程式为2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1189KJ/mol;
故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1189KJ/mol;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式中生成的氢气不稳定,燃烧会放热,所以a<238.6;
故答案为:<;
(3)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料甲醇的电极为负极,电极反应式为:CH3OH-6e-+8OH-=C032-+6H2O;
故答案为:负,CH3OH-6e-+8OH-=C032-+6H2O;
(4)常温下,N2与H2O反应生成NH3的反应为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),
反应焓变△H=2×941KJ/mol+6×2×460KJ/mol-(4×3×393KJ/mol+3×499KJ/mol)=1189KJ/mol,
热化学方程式为2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1189KJ/mol;
故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1189KJ/mol;
点评:本题考查了热化学方程式的书写和分析判断,原电池原理的分析,电极书写方法,燃烧热概念的应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目






 △H═+88.6kJ/mol
△H═+88.6kJ/mol
