题目内容
【题目】(1)完全燃烧一定质量的无水乙醇,放出的热量为QkJ,为完全吸收生成的CO2,并使之生成正盐,消耗0.8mol/L NaOH溶液50mL,则燃烧1mol酒精放出的热量是_________________。
(2)白磷与氧可发生如下反应:P4+5O2=P4O10。
已知断裂下列化学键需要吸收的能量分别为:
P-P akJ·mol-1、P-O bkJ·mol-1、
P=O ckJ·mol-1、O=O dkJ·mol-1
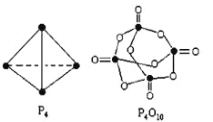
根据图示的分子结构和有关数据计算该反应的反应热__________________。
(3)现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=-19.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_______________。
【答案】
(1)100Q kJ;
(2)(6a+5d-4c-12b) kJ·mol-1
(3)FeO(s)+CO(g)=Fe(s)+CO2(g)ΔH=-11kJ·mol-1
【解析】
试题分析:(1)0.8mol/L的NaOH溶液50ml:n(NaOH)=0.05L×0.8mol/L=0.04mol,CO2与NaOH溶液反应:2NaOH+CO2═Na2CO3+H2O,则由CO2~2NaOH可知,n(CO2)=0.02mol,则n(C2H6O)=![]() ×n(CO2)=0.01mol,放出的热量为QkJ,所以1mol乙醇完全燃烧放出的热量为100QkJ,故答案为:100Q kJ;
×n(CO2)=0.01mol,放出的热量为QkJ,所以1mol乙醇完全燃烧放出的热量为100QkJ,故答案为:100Q kJ;
(2)各化学键键能为P-P a kJmol-1、P-O b kJmol-1、P=O c kJmol-1、O=O d kJmol-1。反应热△H=反应物总键能-生成物总键能,所以反应P4+5O2=P4O10的反应热△H=6akJmol-1+5dkJmol-1- (4ckJmol-1+12bkJmol-1)=(6a+5d-4c-12b)kJmol-1,故答案为:(6a+5d-4c-12b)kJmol-1;
(3)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol……①,
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ/mol……②,
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=-19.4kJ/mol……③,
①×3-②-③×2得:6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)
△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(-19.4kJ/mol)×2=-11kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol。






