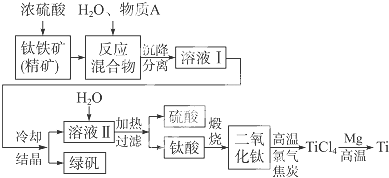
题目内容
19.将Na2O2、Al2O3两种物质同时置于水中,待固体溶解后,向所得溶液中通入一定量HCl气体,所得溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )| A. | 3:2:1 | B. | 2:4:1 | C. | 2:3:1 | D. | 4:2:1 |
分析 向所得溶液中通入一定量HCl气体,所得溶液呈中性,则反应后溶质为NaCl,根据反应2Na2O2+2H2O=4NaOH+O2↑、4NaOH+4HCl=4NaCl+4H2O及质量守恒定律可知:只要Na2O2、HCl的物质的量之比为1:2即可.
解答 解:向所得溶液中通入一定量HCl气体,所得溶液呈中性,则反应后溶质为NaCl,
由反应2Na2O2+2H2O=4NaOH+O2、4NaOH+4HCl=4NaCl+4H2O,根据质量守恒定律可知:Na2O2、HCl的物质的量之比为1:2,
则Na2O2、HCl、Al2O3的物质的量之比可以为1:2:n,其中n可以是任意值,
满足条件的为B,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理及反应后溶质组成为氯化钠为解答关键,试题充分考查了学生分析能力及化学计算能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
9.下图是吸热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
7.超级储能可充电氟镁动力电池性能比电池优良,其工作原理如图所示,电池总反应为Mg+2MnF3═2MnF2+MgF2.下列有关说法正确的是( )


| A. | b为负极 | |
| B. | 该电池放电时,Cu集流板上Cu失电子 | |
| C. | 充电时,F-通过交换膜从b极区移向a极区 | |
| D. | 充电时,阳极的电极反应式为2MnF2+2F--2e-═2MnF3 |
14.精炼铜的过程中,电解质溶液中的[Fe2+]、[Zn2+]会逐渐增大而影响进一步电解. 甲同学设计下图除杂方案:
已知:
请回答下列问题:
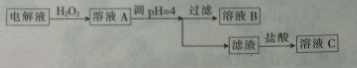
(1)加入H2O2目的是将Fe2+氧化为Fe3+.
(2)乙同学认为应将方案中的pH调节至8,你认为此观点不正确(填“正确”或“不正确”)理由是同时会使Cu2+生成沉淀而除去.
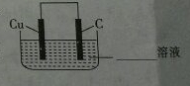
(3)利用铜棒、石墨棒和溶液C(填“B”或“C”)可设计一个原电池.该原电池的正极反应式为Fe3++e-=Fe2+.请在下图中完成该原电池的设计(标出电解质溶液和电子流动方向).
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |

(1)加入H2O2目的是将Fe2+氧化为Fe3+.
(2)乙同学认为应将方案中的pH调节至8,你认为此观点不正确(填“正确”或“不正确”)理由是同时会使Cu2+生成沉淀而除去.
(3)利用铜棒、石墨棒和溶液C(填“B”或“C”)可设计一个原电池.该原电池的正极反应式为Fe3++e-=Fe2+.请在下图中完成该原电池的设计(标出电解质溶液和电子流动方向).

11.取两份等质量的铝份和铁粉,分别与足量的盐酸反应,在相同状态下产生的气体体积之比是( )
| A. | 1:1 | B. | 3:2 | C. | 28:9 | D. | 2:3 |
8.将12.8g Cu投入100mL 2mol•L-1 H2SO4和1mol•L-1 HNO3的混合溶液中,生成的气体与适量氧气完全溶于水后,恰好得到500mL溶液,该溶液为( )
| A. | 0.2 mol•L-1 的H2SO4溶液 | |
| B. | 0.2 mol•L-1 的HNO3溶液 | |
| C. | 0.2 mol•L-1 的H2SO4和HNO3混合溶液 | |
| D. | 1 mol•L-1 的H2SO4和HNO3混合溶液 |
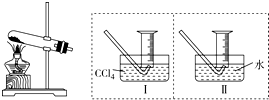 某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.
某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.