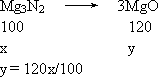题目内容
取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.47 g,冷却后加入足量水,将反应产物加热蒸干并灼烧,得到氧化镁的质量为0.486 g.
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式.
(2)计算燃烧所得混合物中氮化镁的质量分数.
答案:
解析:
解析:
|
答案:(1)Mg3N2+6H2O (2)方法一:设原混合物中Mg3N2的质量为x,由Mg3N2生成MgO的质量为y. (0.470 g-x)+120x/100=0.486 g 所以:x=0.080 g w(Mg3N2)=(0.080 g/0.470 g)×100%=17.0% 方法二(差量法) 所以:m(Mg3N2)=0.080 g w(Mg3N2)=(0.080 g/0.470 g)×100%=17.0% 思路解析:本题考查Mg及其化合物的有关计算.阅读题干和题设问题(1)问可直接做答;(2)问通过已知量由Mg3N2 |

练习册系列答案
相关题目