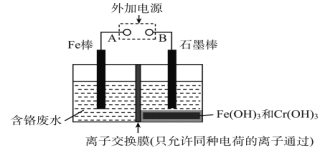
题目内容
【题目】电镀工业上,为了提高镀锌的效果,通常采用Zn(CN)42-溶液代替Zn2+溶液进行电解。请回答下列问题:
(1)元素锌在周期表中的位置为_____________,基态Zn的价电子排布式为_____________。
(2)Zn(CN) 42-所含元素中,电负性最大的元素是_____________,Zn(CN) 42-中含有的化学键类型有σ键和_____________。
(3)CN-中C的杂化类型为_____________,与CN-互为等电子体的单质为_____________。
(4)H2CO3与HNO3的酸性相差较大,请解释其原因_____________。
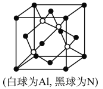
(5)N和Al可组成一种新型半导体材料AlN;AlN具有耐高温,耐磨性能。其晶体类型为_____________,其晶体结构如图,已知晶胞边长为apm,则AlN的密度为_____________(用含a、NA的代数式表示)g/cm3。
【答案】第四周期ⅡB族 3d104s2 N π键 sp N2 HNO3非羟基氧多于H2CO3,非羟基氧吸电子导致—OH中H易电离 原子晶体 ![]()
【解析】
(1)根据元素对应的原子结构判断元素在周期表中的位置;根据构造原理书写其核外电子排布式;
(2)元素的非金属性越强,元素的电负性就越大;单键为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键;
(3)依据价层电子对数判断杂化类型;价电子和原子数分别都相同的分子是等电子体;
(4)含氧酸的酸性强弱与非羟基氧数目有关,非羟基氧数目越多,酸性越强;
(5)原子晶体熔、沸点高、硬度大;运用均摊法计算晶胞中AlN的个数,依据![]() 计算AlN的密度。
计算AlN的密度。
(1)Zn是30号元素,位于周期表第四周期ⅡB族,根据核外电子排布规律可知,Zn的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,价电子排布式为3d104s2,故答案为:第四周期ⅡB族;3d104s2;
(2)元素的非金属性越强,元素的电负性就越大,Zn(CN) 42-所含元素中N元素非金属性最强,电负性最大;[Zn(CN)4]2-中CN-离子中含有C、N叁键,化学键类型有σ键和π键,故答案为:N;π键;
(3)CN-中C原子与N原子之间形成叁键,则C的杂化类型为sp杂化;价电子和原子数分别都相同的分子是等电子体,所以和CN-互为等电子体的单质分子是氮气,故答案为:sp杂化;N2;
(4)H2CO3与HNO3都为含氧酸,硝酸中含有2个非羟基氧,碳酸中含有1个非羟基氧,非羟基氧越多,吸电子能力更强,导致—OH中H更易电离,故答案为:HNO3非羟基氧多于H2CO3,非羟基氧吸电子导致—OH中H易电离;
(5)原子晶体熔、沸点高、硬度大,根据AlN具有有耐高温、,耐磨性能的性质可知,AlN为原子晶体;由晶胞结构示意图可知,晶胞中含有4个AlN,则晶胞的质量为![]() g,晶胞的体积为(a×10—10m)3,则有d(a×10—10m)3=
g,晶胞的体积为(a×10—10m)3,则有d(a×10—10m)3=![]() ,d=
,d=![]() ,故答案为:原子晶体;
,故答案为:原子晶体;![]() 。
。

 应用题作业本系列答案
应用题作业本系列答案