题目内容
现配制500mL0.5mol/L的NaOH溶液,需要的仪器除用量筒、烧杯、玻璃棒外,还需要的玻璃仪器有(1) .用托盘天平称量氢氧化钠固体时,应在小烧杯里应称量(2) 克氢氧化钠.配制过程主要有:溶解、(3) 、转移、 、加水稀释、定容、摇匀,而后转移到试剂瓶里并贴上标签.若取上述溶液100mL,其物质的量浓度为(4) 如果其它各项操作均正常,仅有一项下列操作时,
(5)对配制结果有何影响(填偏高、偏低、无影响或无法确定)?
定容时俯视刻度线 .
配制前容量瓶不干燥 .
定容后摇匀时有液体贱出 .
(5)对配制结果有何影响(填偏高、偏低、无影响或无法确定)?
定容时俯视刻度线
配制前容量瓶不干燥
定容后摇匀时有液体贱出
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据n=cV和m=nM来计算;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析;
(4)根据溶液是均一的,溶液的浓度与溶液所取的体积无关;
(5)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)根据n=cV和m=nM来计算;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析;
(4)根据溶液是均一的,溶液的浓度与溶液所取的体积无关;
(5)根据c=
| n |
| V |
解答:
解:(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、量筒(可用可不用).
根据提供的仪器可知,还需仪器有托盘天平、500ml容量瓶、胶头滴管,故答案为:托盘天平、500ml容量瓶、胶头滴管;
(2)根据n=cV可知需要的NaOH的物质的量n=0.5L×0.5mol/L=0.25mol,质量m=nM=0.25mol×40g/mol=10.0g,故需要的质量为10.0g.
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知,答案为:冷却、洗涤;
(4)根据溶液是均一的,溶液的浓度与溶液所取的体积无关,故取上述溶液100mL,其物质的量浓度仍为0.5mol/L,故答案为:0.5mol/L;
(5)定容时俯视刻度线,会导致溶液体积偏小,浓度偏高,故答案为:偏高;
若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:无影响;
定容后摇匀时有液体贱出,对浓度无影响,故答案为:无影响.
根据提供的仪器可知,还需仪器有托盘天平、500ml容量瓶、胶头滴管,故答案为:托盘天平、500ml容量瓶、胶头滴管;
(2)根据n=cV可知需要的NaOH的物质的量n=0.5L×0.5mol/L=0.25mol,质量m=nM=0.25mol×40g/mol=10.0g,故需要的质量为10.0g.
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知,答案为:冷却、洗涤;
(4)根据溶液是均一的,溶液的浓度与溶液所取的体积无关,故取上述溶液100mL,其物质的量浓度仍为0.5mol/L,故答案为:0.5mol/L;
(5)定容时俯视刻度线,会导致溶液体积偏小,浓度偏高,故答案为:偏高;
若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:无影响;
定容后摇匀时有液体贱出,对浓度无影响,故答案为:无影响.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应.若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液中SO42-的物质的量浓度比为( )
| A、1:2:3 |
| B、1:6:9 |
| C、1:3:3 |
| D、1:3:6 |
下列图示实验合理的是( )
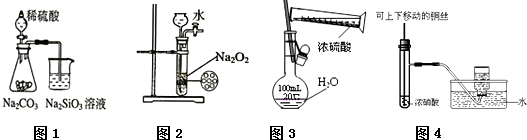

| A、图1为证明非金属性强弱:S>C>Si |
| B、图2为制备少量氧气 |
| C、图3为配制一定物质的量浓度的硫酸溶液 |
| D、图4为制备并收集少量NO2气体 |
 图中的实验装置可用于制取乙炔.
图中的实验装置可用于制取乙炔. 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 某一位同学为了测定三聚氰胺的分子式,设计了如图实验:
某一位同学为了测定三聚氰胺的分子式,设计了如图实验: