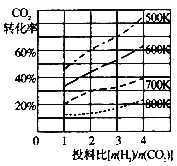
题目内容
【题目】氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
N2(g)+3H2(g)![]() 2NH3(g);回答下列问题:
2NH3(g);回答下列问题:
(1)氮元素在元素周期表的位置为______________,N2的结构式为______________
(2)在一个容积为2L的密闭容器中上述反应。反应开始时,各物质的量分别为:n(N2)=2mol,n(H2)=4mol,2min后n(H2)=1mol。
v表示反应速率,下列正确的是______________
A.2min末时n(NH3)=2.0molB.v(N2)=0.25mol·L-1·min-1
C.v(NH3)=1.0mol·L-1·min-1D.2min末时N2的浓度为0.5mol·L-1
(3)在350℃、30MPa下合成氨气时,n(NH3)和n(H2)(n表示物质的量)随时间变化的关系如下图所示,下列正确的是______________。
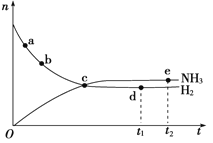
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,如果加入适当催化剂可以使该反应加快
(4)氮可以形成多种离子和分子,如N3-、NH2-、N2H4、N2H5+、N2H62+等,已知N2H5+、N2H62+是中性分子N2H4结合质子生成的,有与NH4+相似的性质。
①写出N2H5+与强碱反应的离子方程式为:______________。
②在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,两者反应生成两种不污染环境的物质。写出N2H4电子式______________,该反应的化学方程式为______________。
③写出与N3-电子数相等的一种分子的分子式______________。
【答案】(1)第二周期VA族;N≡N;(2)ABD;(3)AD;
(4)①N2H5++OH-=N2H4·H2O或N2H5++OH-=N2H4+H2O;②![]() ;N2H4+2H2O2=N2↑+4H2O
;N2H4+2H2O2=N2↑+4H2O
③CO2或N2O、BeF2;
【解析】
试题分析:(1)氮元素在元素周期表中位于第二周期VA族,N2的结构式为N≡N,故答案为:第二周期VA族;N≡N;
(2)在一个容积为2L的密闭容器中上述反应。反应开始时,各物质的量分别为:n(N2)=2mol,n(H2)=4mol,2min后n(H2)=1mol。根据N2+3H2![]() 2NH3,2min末时n(NH3)=2.0mol,A正确;v(H2)=
2NH3,2min末时n(NH3)=2.0mol,A正确;v(H2)= =0.75mol/(L·min),v(N2)=
=0.75mol/(L·min),v(N2)=![]() ×0.75mol/(L·min)=0.25mol/(L·min),B正确;v(NH3)=
×0.75mol/(L·min)=0.25mol/(L·min),B正确;v(NH3)=![]() ×0.75mol/(L·min)=0.50mol/(L·min),C错误;2min末时N2的浓度为
×0.75mol/(L·min)=0.50mol/(L·min),C错误;2min末时N2的浓度为![]() -0.25mol/(L·min)×2min=0.5mol/L,D正确;故选ABD。
-0.25mol/(L·min)×2min=0.5mol/L,D正确;故选ABD。
(3)A.随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A正确;B.c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;C.d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;D.其他条件不变,如果加入适当催化剂可以使该反应速率加快,故D正确。故选AD。
(4)①N2H62+中N的化合价为+4价,N2H62+是由中性分子N2H4结合2个质子形成的,故N2H62+相当于二元酸,故在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O,故答案为:N2H62++2OH-=N2H4+2H2O;
②N2H4的电子式为:![]() ,在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,两者反应的化学方程式为N2H4+2H2O2=N2↑+4H2O,故答案为:
,在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,两者反应的化学方程式为N2H4+2H2O2=N2↑+4H2O,故答案为:![]() ;N2H4+2H2O2=N2↑+4H2O;
;N2H4+2H2O2=N2↑+4H2O;
③含有22个电子的三原子物质有N2O、CO2、CNO-、BeF2、CaH2、C3H4等,故答案为:CO2等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案