题目内容
(16分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):
;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):__________________
_____________________ _____________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
(16分)(每空2分,共16分)
(1)酸,< ,Ag+ + H2O  AgOH + H+ ,抑制 。
AgOH + H+ ,抑制 。
(2)酸,Al3++3H2O ![]() Al(OH)3+3H+, Al2O3 ;
Al(OH)3+3H+, Al2O3 ;
(3)NaOH。
解析:略

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
(16分)现有A、B、C、D、E可溶于水的五种化合物,其组成的离子如下表,且每种离子只有一次。
| 阳离子 | Ag+ Na+ Fe3+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- SO32— NO SO42— |
①C溶液显黄色,其它溶液均为无色溶液。
②已知向B、C、D、E溶液分别加入A溶液均产生白色沉淀;
③B溶液与适量E溶液反应生成白色沉淀,加入过量E溶液,白色沉淀量减少,但不完全消失。
(1)据此推断它们的化学式:
A__________;B__________;C________;D________;E________。
(2)B溶液加入少量E溶液的离子方程式____________________________________。
(3)向C溶液滴加少量的D溶液的离子方程式_________________________________。
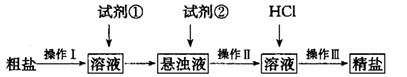
 溶液作试剂,设计提纯含有少量
溶液作试剂,设计提纯含有少量 的粗盐。其实验方案如下:
的粗盐。其实验方案如下:

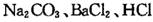 溶液作试剂,设计提纯含有少量
溶液作试剂,设计提纯含有少量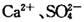 的粗盐。其实验方案如下:
的粗盐。其实验方案如下: