题目内容
某盐酸的ρ=1.18g/cm3,HCl的质量分数为36.5%.取200mL该盐酸与过量铁屑充分反应,若反应后溶液体积变化忽略不计,则FeCl2物质的量浓度是
- A.5.9mol/L
- B.1.18mol/L
- C.11.8mol/L
- D.无法计算
A
分析:根据c= 计算盐酸的物质的量浓度,再利用Fe+2HCl═FeCl2+H2↑来计算FeCl2物质的量浓度.
计算盐酸的物质的量浓度,再利用Fe+2HCl═FeCl2+H2↑来计算FeCl2物质的量浓度.
解答:盐酸的ρ=1.18g/cm3,HCl的质量分数为36.5%,
由c= 可知,
可知,
c(HCl)=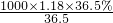 =11.8mol/L,
=11.8mol/L,
由Fe+2HCl═FeCl2+H2↑可知
c(FeCl2)=c(HCl)× =11.8mol/L×
=11.8mol/L× =5.9mol/L,
=5.9mol/L,
故选A.
点评:本题考查物质的量浓度的计算,明确计算公式及发生的化学反应即可解答,难度不大.
分析:根据c=
 计算盐酸的物质的量浓度,再利用Fe+2HCl═FeCl2+H2↑来计算FeCl2物质的量浓度.
计算盐酸的物质的量浓度,再利用Fe+2HCl═FeCl2+H2↑来计算FeCl2物质的量浓度.解答:盐酸的ρ=1.18g/cm3,HCl的质量分数为36.5%,
由c=
 可知,
可知,c(HCl)=
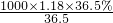 =11.8mol/L,
=11.8mol/L,由Fe+2HCl═FeCl2+H2↑可知
c(FeCl2)=c(HCl)×
 =11.8mol/L×
=11.8mol/L× =5.9mol/L,
=5.9mol/L,故选A.
点评:本题考查物质的量浓度的计算,明确计算公式及发生的化学反应即可解答,难度不大.

练习册系列答案
相关题目
在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,T℃ 25℃(填“大于”、“小于”或“等于”),该温度下水的离子积Kw= ;
(2)a= b= ,原Ba(OH)2稀溶液的物质的量浓度为 ;
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为 ,其中Na2SO4的物质的量浓度为 .
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(2)a=
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为
 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
