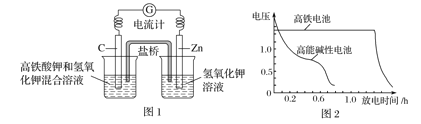
题目内容
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________,A元素在元素周期表中的位置是__________,B原子的结构示意图为__________,A、B、C、D四种元素的离子半径从大到小的顺序是__________(用离子符号表示)。
(2)单质A有两种同素异形体,其中沸点高的是_____(填分子式),原因是_______;A和B的氢化物所属的晶体类型分别为______和______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为___,中心原子的杂化轨道类型为___。
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为______
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F的化学式为_____:晶胞中A 原子的配位数为______;列出晶体F的密度(g.cm-3)计算式_____。

【答案】O ls22s22p63s23p3(或[Ne]3s23p3) 第二周期第VIA族 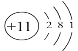 P3->Cl->O2->Na+ O3 O3分子量大 分子晶体 离子晶体 三角锥 sp3 V形 4 Na2O 8
P3->Cl->O2->Na+ O3 O3分子量大 分子晶体 离子晶体 三角锥 sp3 V形 4 Na2O 8 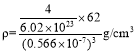
【解析】
A、B、C、D为原子序数依次增大的四种元素,C核外电子总数是最外层电子数的3倍,则C为P元素,C、D为同周期元素,D元素最外层有一个未成对电子,则D为Cl元素,A2-和B+具有相同的电子构型,则A为O、B为Na元素;通过以上分析,A、B、C、D分别是O、Na、P、Cl元素。
(1)元素的非金属性越强,其电负性越大,这几种元素非金属性最强的是O元素,则电负性最大的是O元素;C是P元素,其原子核外有15个电子,根据构造原理书写P原子核外电子排布式为ls22s22p63s23p3(或[Ne]3s23p3);A元素为O元素,其在元素周期表中的位置为第二周期第ⅥA族;B元素为Na元素,其原子结构示意图为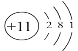 ;相同结构的离子,原子序数越小半径越大,电子层数越多半径越大,故四种元素的简单离子半径从大到小为P3->Cl->O2->Na+;
;相同结构的离子,原子序数越小半径越大,电子层数越多半径越大,故四种元素的简单离子半径从大到小为P3->Cl->O2->Na+;
(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对分子质量较大,则范德华力较大,沸点较高;A的氢化物为水,为分子晶体,B的氢化物为NaH,为离子晶体;
(3)C和D反应可生成组成比为1:3的化合物PCl3,PCl3中P原子价层电子对个数=3+![]() =4且含1个孤电子对,根据价层电子对互斥理论判断该分子的立体构型为三角锥形、中心原子的杂化轨道类型为sp3;
=4且含1个孤电子对,根据价层电子对互斥理论判断该分子的立体构型为三角锥形、中心原子的杂化轨道类型为sp3;
(4)化合物D2A为Cl2O,O为中心原子,形成2个σ键,孤电子对数为![]() =2,则中心原子的价层电子对数为4,立体构型为V形;
=2,则中心原子的价层电子对数为4,立体构型为V形;
(5)O和Na能够形成化合物F,半径大的为O2-、半径小的为Na+,该晶胞中大球个数=![]() =4、小球个数为8,则大球、小球个数之比=4:8=1:2,则化学式为Na2O;观察晶胞中面心的原子,与之相连的原子有8个,晶胞中O原子的配位数为8;该晶胞体积=a3,晶胞密度=
=4、小球个数为8,则大球、小球个数之比=4:8=1:2,则化学式为Na2O;观察晶胞中面心的原子,与之相连的原子有8个,晶胞中O原子的配位数为8;该晶胞体积=a3,晶胞密度=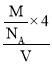 =
=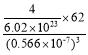 g.cm-3。
g.cm-3。

 名校课堂系列答案
名校课堂系列答案