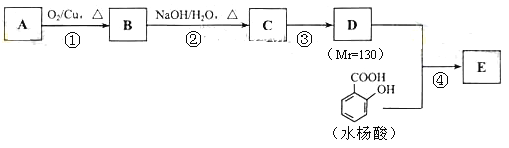
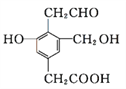
题目内容
【题目】25 ℃时,用浓度为0.100 0 mol·L-1的氢氧化钠溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是 ( )
数据编号 | 滴入NaOH(aq) 的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A. 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B. 由表中数据可估算出Ka(HX)≈10-5
C. HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-)
D. 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+)
【答案】D
【解析】A.0.1000molL-1的酸HX、HY的pH分别为3、1,可知HX为弱酸、HY为强酸,HY溶液中离子浓度更大,同浓度的两种酸溶液的导电能力顺序HX<HY,故A正确;B.0.100mol/L的HX溶液的pH=3,则c(H+)≈c(X-)=10-3mol/L,c(HX)=0.1mol/L-c(X-)≈0.1mol/L,则Ka(HX)=  =
=![]() =10-5,故B正确;C.HY和HX混合,根据电荷守恒:c(H+)=c(X-)+c(Y-)+c(OH-),故C正确;D.上述②反应后的HX溶液显中性,因为HX为弱酸,则a<20.00 mL,由于HY为强酸,故HY酸过量,c(H+)>c(OH-),结合电荷守恒可知:c(Y-)>c(Na+),溶液中正确的离子浓度大小为:c(Y-)>c(Na+)>c(H+)>c(OH-),故D错误;故选D。
=10-5,故B正确;C.HY和HX混合,根据电荷守恒:c(H+)=c(X-)+c(Y-)+c(OH-),故C正确;D.上述②反应后的HX溶液显中性,因为HX为弱酸,则a<20.00 mL,由于HY为强酸,故HY酸过量,c(H+)>c(OH-),结合电荷守恒可知:c(Y-)>c(Na+),溶液中正确的离子浓度大小为:c(Y-)>c(Na+)>c(H+)>c(OH-),故D错误;故选D。

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目