题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
【答案】D
【解析】
A.3Fe+4H2O(g)![]() Fe3O4+4H2,则0.2molFe与足量水蒸气反应,生成的H2分子数目为
Fe3O4+4H2,则0.2molFe与足量水蒸气反应,生成的H2分子数目为![]() =0.27NA,A不正确;
=0.27NA,A不正确;
B.没有提供pH=13的NaOH溶液的体积,无法计算由水电离的OH-离子数目,B不正确;
C.氢氧燃料电池正极消耗O2的体积为22.4L(标准状况),电路中通过的电子数目为![]() =4NA,C不正确;
=4NA,C不正确;
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应,生成4molN2时,转移电子的物质的量为15mol,则生成28gN2(物质的量为1mol)时,转移的电子数目为
2HNO3+4N2↑+9H2O反应,生成4molN2时,转移电子的物质的量为15mol,则生成28gN2(物质的量为1mol)时,转移的电子数目为![]() =3.75NA,D正确;
=3.75NA,D正确;
故选D。

【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为______________________。
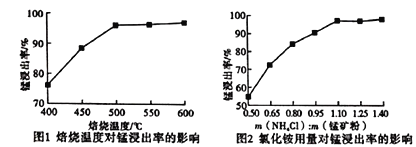
(2)分析下列图1、图2,氯化铵焙烧菱镁矿的最佳条件是:焙烧温度_________,氯化铵与菱镁矿粉的质量之比为_________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式______;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为_________。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时,c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为____________________________。
(5)流程中能循环利用的固态物质是____________。
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )

A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |


