题目内容
3.下列离子方程式书写正确的是( )| A. | 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2 H2O | |
| B. | 碳酸钠溶液与醋酸反应 CO32-+2H+=CO2↑+H2O | |
| C. | Ca (ClO)2溶液中通入过量的二氧化硫气体 ClO-+H2O+SO2=HSO3-+HClO | |
| D. | 硫化氢气体通入硫酸铁溶液中:H2S+2Fe3+=2Fe2++S↓+2H+ |
分析 A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液反应生成碳酸钙和碳酸氢钠和水;
B.醋酸是弱电解质,保留化学式;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫;
D.硫化氢气体通入硫酸铁溶液中发生氧化还原反应生成硫酸铁和硫.
解答 解:A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液,离子方程式:Ca2++HCO3-+OH-=CaCO3↓+H2O,故A错误;
B.碳酸钠溶液与醋酸反应,离子方程式:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-,故B错误;
C.Ca (ClO)2溶液中通入过量的二氧化硫气体,离子方程式:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+SO42-+4H++2Cl-,故D错误;
D.硫化氢气体通入硫酸铁溶液中,离子方程式:H2S+2Fe3+=2Fe2++S↓+2H+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,侧重考查反应物用量不同发生反应不同,题目难度不大.

练习册系列答案
相关题目
13.随着卤素原子序数的增加,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐降低 | B. | 卤素原子半径逐浙减少 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐减弱 |
14.下列各组物质中既不是同分异构体又不是同素异形体、同系物或同位素的是( )
| A. | HCOOC2H5 CH3CH2COOH | B. | 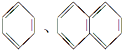 | ||
| C. | O2、O3 | D. | H、D、T |
11.下列是几种原子的基态电子排布,电负性最大的原子是( )
| A. | 1s22s22p4 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p3 | D. | 1s22s22p63s23p64s2 |
8.将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为2.24L.将反应后的固体残渣与过量的稀盐酸反应,又生成3.36L的CO2.(以上或以下气体体积均为标准状况时的体积),下列判断正确的是( )
| A. | 原固体混合物中NaHCO3的物质的量为0.2mol | |
| B. | 固体残渣的成分为NaOH和Na2CO3的混合物 | |
| C. | 原固体混合物中NaOH和NaHCO3的物质的量之比为2﹕5 | |
| D. | 原固体混合物中加入过量盐酸会放出5.6L气体 |
15.丁烷的一氯代物的同分异构体有多少种( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
13.下列关于乙炔制取的说法不正确的是( )
| A. | 为了减慢反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 为了除去杂质气体,可用硫酸铜溶液 | |
| D. | 反应中需加碎瓷片作沸石 |
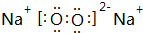 .
. ,空间构型直线型,属于非极性分子(填“极性”或“非极性”)
,空间构型直线型,属于非极性分子(填“极性”或“非极性”)