题目内容
【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
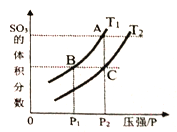
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。
【答案】 PCl5(g) ![]() PCl3(g)+Cl2(g) ΔH=+93kJ/mol ΔH1<0 CO的平衡转化率为75% C T12 该反应是放热反应,温度低,有利于平衡往正方向移动,图象中,等压条件下,T1的SO3体积分数大于T2的SO3体积分数。所以T12 (2分)。 增大体系压强,使用催化剂
PCl3(g)+Cl2(g) ΔH=+93kJ/mol ΔH1<0 CO的平衡转化率为75% C T12 该反应是放热反应,温度低,有利于平衡往正方向移动,图象中,等压条件下,T1的SO3体积分数大于T2的SO3体积分数。所以T12 (2分)。 增大体系压强,使用催化剂
【解析】⑴.①. 2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
②2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
由盖斯定律可知(①②)÷2得到PCl5(g)═PCl3(g)+Cl2(g) 则△H=+93kJ/mol,故答案为:PCl5(g)═PCl3(g)+Cl2(g) 则△H=+93kJ/mol;
⑵.由表中数据可知,温度越高,K越小,说明升高温度,平衡逆向移动,则正反应为放热反应,△H1<0;
根据反应方程式中各物质的关系式知,平衡时,c(CO)=0.005mol/L、c(H2)=0.015mo/L,
参加反应的c(CO)=c(H2)=0.015mo/L,一氧化碳的转化率=0.015mol/L÷(0.005mol/L+0.015mol/L)×100%=75%,
故答案为:ΔH1<0;CO的平衡转化率为75%;
⑶. A、可逆反应到达平衡时SO2和SO3浓度不一定相等,与二氧化硫的起始浓度以及转化率有关,故A错误;
B、密闭容器中体积恒定,质量守恒,所以混合气体的密度始终不变,不能判断平衡状态,故B错误;
C、在一定体积的绝热密闭容器中,随着反应的进行,容器内的温度一直在改变,则温度不变时,说明反应达到了平衡状态,故C正确;
D、SO3的生成速率与SO2的消耗速率都表示正反应速率,不能说明达到平衡状态,故D错误;
该反应是放热反应,升高温度平衡逆向移动,SO3的体积分数减小,即温度越高,SO3的体积分数越小,所以T1<T2;根据影响反应速率的因素,如果要加快正反应的速率,除了改变温度,还可以用增大压强、使用催化剂的方法;
故答案为:C;T1<T2;该反应是放热反应,温度低,有利于平衡往正方向移动,图象中,等压条件下,T1的SO3体积分数大于T2的SO3体积分数。所以T1<T2 ;增大体系压强,使用催化剂。

【题目】现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19.在它们的化合物中,主要化合价均不止一种,但有一种相同的化合价.它们的部分性质如下:
元素 | A | B | C | D |
原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
最高正化合价 | ﹣4 | +4 |
(1)A元素在元素周期表中的位置为 .
(2)含D元素的两种常见共价化合物发生化合反应可生成一种离子化合物,该反应的化学方程式为 .
(3)B的单质与D的最高价氧化物对应的水化物在加热条件下发生反应的化学方程式为 .
(4)C单质与Al具有某些相似性,比如能与强碱反应,写出C单质与NaOH溶液反应的化学方程式: .
(5)A、B、C、D均可形成分子中含18电子的氢化物,这些氢化物的分子式分别为 .