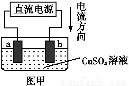
题目内容
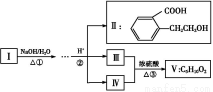
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
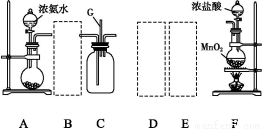
(1)装置F中发生反应的离子方程式为 。
(2)装置A中的烧瓶内固体可选用 (填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
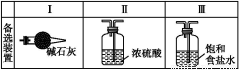
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D ,E (均填编号)。
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵: 。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?
。
(1)MnO2+4H++2Cl- M
M +Cl2↑+2H2O
+Cl2↑+2H2O
(2)A、B、E
(3)Ⅰ Ⅱ Ⅲ
(4)取一定量该固体加水溶解,将该溶液分成两份于试管中,向其中一份中加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝,说明含N ;向另一份溶液中加入HNO3酸化,然后加入AgNO3,出现白色沉淀,说明含Cl-;通过上述现象即可证明该固体是氯化铵
;向另一份溶液中加入HNO3酸化,然后加入AgNO3,出现白色沉淀,说明含Cl-;通过上述现象即可证明该固体是氯化铵
(5)将尾气通入盛有稀NaOH溶液的烧杯中
【解析】(1)装置F是用来在加热条件下制取氯气。(2)装置A是用固液不加热法制取氨气的,因此固体可选用碱石灰、生石灰、烧碱。(3)B、D是吸水装置,分别用碱石灰、浓硫酸,E为除去氯气中HCl气体,可以用饱和食盐水。(4)氯化铵的检验,要检验N 和Cl-。常常用碱液与N
和Cl-。常常用碱液与N 反应能放出NH3检验N
反应能放出NH3检验N 的存在,而用HNO3和AgNO3检验Cl-的存在。(5)装置C的出气管口处逸出的尾气可能含有氯气或HCl或NH3,可用稀NaOH溶液吸收。
的存在,而用HNO3和AgNO3检验Cl-的存在。(5)装置C的出气管口处逸出的尾气可能含有氯气或HCl或NH3,可用稀NaOH溶液吸收。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案