题目内容
 舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.(1)请写出实验室制氯气的反应化学方程
(2)反应方程式中氧化剂和还原剂物质的量之比为
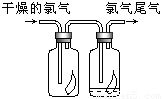
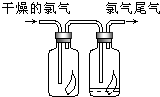
(3)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(4)实验室中剩余的Cl2尾气通常用NaOH溶液吸收,发生反应的离子方程式
分析:(1)实验室制氯气是利用二氧化锰和浓盐酸反应制备的;
(2)根据得失电子守恒,以及氧化产物的概念分析判断;
(3)根据氯气和次氯酸的性质分析;
(4)实验室中剩余的Cl2尾气能污染空气,要用NaOH溶液吸收.
(2)根据得失电子守恒,以及氧化产物的概念分析判断;
(3)根据氯气和次氯酸的性质分析;
(4)实验室中剩余的Cl2尾气能污染空气,要用NaOH溶液吸收.
解答:解:(1)实验室制氯气是利用二氧化锰和浓盐酸反应生成MnCl2、Cl2和H2O,所以其反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)在MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,MnO2得电子失氧化剂,HCl失电子是还原剂,当有1molMnO2反应时,有2molHCl被氧化,氧化剂与还原剂物质的量关系为1:2,HCl失电子被氧化产物是氯气是氧化产物,故答案为:1:2;氧化;
(3)氯气不能使有色布条褪色,当氯气遇到水或水蒸气时,氯气与水反应生成次氯酸,次氯酸具有漂白性能使有色布条褪色,
故答案为:干燥有色布条不褪色,湿润的有色布条褪条;氯气不具有漂白性,次氯酸具有漂白性;
(4)实验室中剩余的Cl2尾气能污染空气,要用NaOH溶液吸收,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)在MnO2+4HCl(浓)
| ||
(3)氯气不能使有色布条褪色,当氯气遇到水或水蒸气时,氯气与水反应生成次氯酸,次氯酸具有漂白性能使有色布条褪色,
故答案为:干燥有色布条不褪色,湿润的有色布条褪条;氯气不具有漂白性,次氯酸具有漂白性;
(4)实验室中剩余的Cl2尾气能污染空气,要用NaOH溶液吸收,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评:本题考查了实验室制备氯气的方法,氧化还原反应,氯气和次氯酸漂白性实验,题目难度不大,注意把握盐酸在反应中的化合价的变化.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目