题目内容
14.下列说法正确的是( )| A. | 能使甲基橙显红色的溶液中大量存在:Mg2+、Na+、Cl-、F- | |
| B. | 标准状况下,46gNO2和N2O4混合气体中含有原子个数为3NA | |
| C. | 1L0.5mol•L-1 CuSO4溶液中含有0.5NA个Cu2+ | |
| D. | 浓度均为0.1 mol/L的氨水和盐酸、由水电离出的c(H+):盐酸>氨水 |
分析 A.能使甲基橙显红色的溶液中存在大量氢离子,氟离子与氢离子结合生成HF;
B.NO2和N2O4的分子组成最简比为NO2,根据NO2计算出混合物中含有的原子个数;
C.铜离子在溶液中部分水解,导致铜离子数目减少;
D.氨水和盐酸都抑制了水的电离,氨水中氢氧根离子浓度小于盐酸中的氢离子,则氨水中水电离的氢离子大于盐酸.
解答 解:A.能使甲基橙显红色的溶液为酸性溶液,溶液中存在大量氢离子,F-与酸性溶液中的氢离子结合生成氟化氢,在溶液中不能大量共存,故A错误;
B.46gNO2和N2O4混合气体中含有46g最简比NO2,其物质的量为1mol,1molNO2中含有3mol原子,含有原子个数为3NA,故B正确;
C.1L0.5mol•L-1 CuSO4溶液中含有溶质硫酸铜0.5mol,由于铜离子部分水解,则溶液中的铜离子小于0.5mol,含有的铜离子小于0.5NA,故C错误;
D.酸和碱溶液都抑制了水的电离,溶液中氢离子或氢氧根离子浓度越大,水的电离程度越小,由于氨水中氢氧根离子浓度小于盐酸中的氢离子,则氨水中水电离的氢离子大于盐酸中水电离的氢离子,故D错误;
故选B.
点评 本题考查了离子共存、阿伏伽德罗常数、弱电解质电离及其影响等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
9.已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )

| A. | 每生成2分子AB吸收bkJ热量 | |
| B. | 该反应中反应物的总能量高于生成物的总能量 | |
| C. | 断裂1molA-A键和1molB-B键,放出a kJ能量 | |
| D. | 该反应焓变为△H=+(a-b) kJ/mol |
8.金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可采用电解其熔融物法回收锂而循环使用.其工作示意图如右图,下列说法不正确的是( )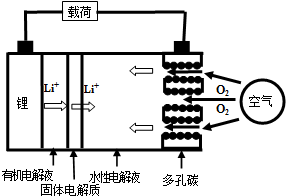

| A. | 放电时负极的电极反应式为:Li-e-=Li+ | |
| B. | 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到 | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
9.下列有机反应的方程式书写错误的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | 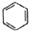 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$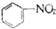 +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$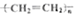 |
 $→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$
$→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$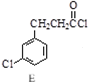 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$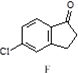
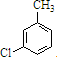 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.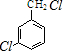 +3NaOH$→_{催化剂}^{高温、高压}$
+3NaOH$→_{催化剂}^{高温、高压}$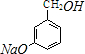 +2NaCl+H2O.
+2NaCl+H2O. (任写一种).
(任写一种). .
.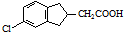 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下:
 ;羰基硫分子的电子式为
;羰基硫分子的电子式为 .
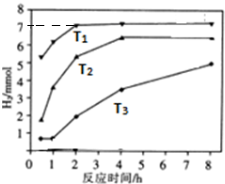
.
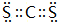 ,Y3-的立体构型为直线形.
,Y3-的立体构型为直线形.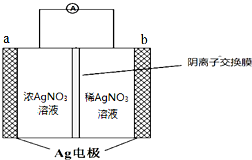 银是一种在工业、生活上有广泛用途的金属.
银是一种在工业、生活上有广泛用途的金属.