题目内容
|
已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O-2e- | |
A. |
ClO2 |
B. |
NaClO4 |
C. |
HClO |
D. |
NaClO |

 特高级教师点拨系列答案
特高级教师点拨系列答案碱式碳酸铜和氯气都是用途广泛的化工原料。
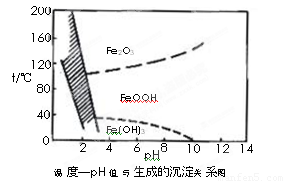
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是???????????? ;
②反应A后调节溶液的pH范围应为?????????????????????????? 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净????????????????????? 。
④造成蓝绿色产品中混有CuO杂质的原因是???????????????????? 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
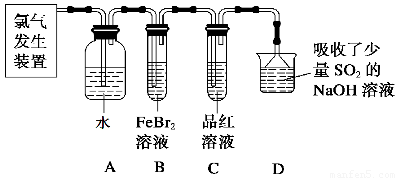
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有??? ????????? ????? 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 ????????? ?? 。此时B装置中发生反应的离子方程式是___________?????????????? _____。
③写出A溶液中具有强氧化性微粒的化学式????????? ??????????????????? ?? 。若向A溶液中加入NaHCO3粉末,会观察到的现象是????????????????????? 。
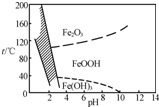 NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下: