题目内容
4.向150mL一定浓度的HNO3中加入44.8 铜片,一段时间后,铜片完全溶解,硝酸恰好完全反应,共收集到气体22.4L(已折算成标准状况),则该HNO3的物质的量浓度是,( )| A. | 10.0mol•L-1 | B. | 16.0 mol•L-1 | C. | 12.4mol•L-1 | D. | 18.7mol•L-1 |
分析 铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量浓度.
解答 解:铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体为NO2和NO,则n(NO2)+n(NO)=$\frac{22.4L}{22.4L/mol}$=1mol,即被还原的硝酸的物质的量为1mol,
44.8g铜的物质的量为:n(Cu)=$\frac{44.8g}{64g/mol}$=0.7mol,则生成n[Cu(NO3)2]=0.7mol,则表现酸性的硝酸的物质的量为:0.7mol×2=1.4mol,
所以参加反应的硝酸的物质的量为:1mol+1.4mol=2.4mol,
该硝酸的物质的量浓度为:$\frac{2.4mol}{0.15L}$=16mol/L,
故选B.
点评 本题考查了化学方程式、物质的量浓度的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.某元素最高正价氧化物对应的水化物的化学式是HnXOm,该元素在气态氢化物中的化合价为( )
| A. | n-2m | B. | 2m-n | C. | 8+n-2m | D. | 2m-n-8 |
9.把1mL0.1mol•L-1的H2SO4稀释成2L溶液,下列有关稀溶液的说法不正确的是( )
| A. | 溶液中的c(OH-)为1×10-10mol/L | |
| B. | 溶液中的c(H+)为1×10-4mol/L | |
| C. | 溶液中由水电离出来的c(OH-)为1×10-10mol/L | |
| D. | 溶液中由水电离出来的H+的浓度为1×10-4mol/L |
13.下列化学方程式书写正确的是( )
| A. | 2P+5O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | B. | Fe2O3+3CO═2Fe+3CO2 | ||
| C. | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ | D. | NaHCO3+HCl═NaCl+H2O+CO2↑ |

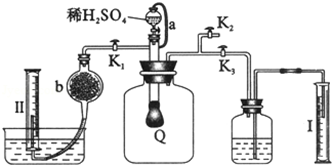
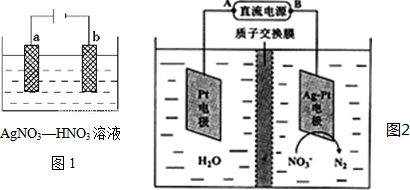
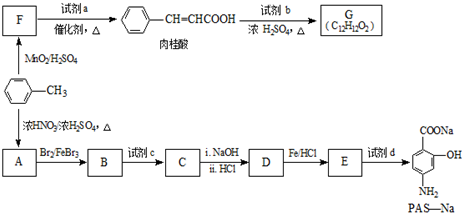
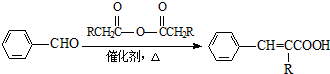 (R=-CH3或-H)
(R=-CH3或-H)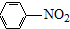 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$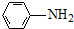
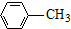 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$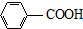
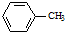 生成A的反应类型是取代反应或硝化反应.
生成A的反应类型是取代反应或硝化反应.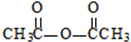 .
.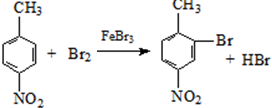 .
.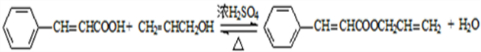 .
.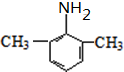 (写出其中一种结构简式).
(写出其中一种结构简式).