题目内容
19.钼(Mo)是生命必需的元素,参与人体内硝酸盐的代谢,阻止致癌物亚硝胺的形成.42108Mo原子核内中子数与核外电子数之差是( )| A. | 24 | B. | 42 | C. | 66 | D. | 108 |
分析 根据在原子中,原子序数=质子数=核电荷数=核外电子数,相对原子质量=质子数+中子数,进行解答.
解答 解:根据在原子中,质子数=核电荷数=核外电子数,可知钬原子的核内质子数=核外电子数=67;依据相对原子质量=质子数+中子数,可得钼原子的中子数为:108-42=66,因此钼元素原子核内中子数与核外电子数之差是66-42=24.
故选:A.
点评 本题考查学生对在原子中,原子序数=质子数=核电荷数=核外电子数,相对原子质量=质子数+中子数理解与在解题中应用的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业
在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2molN2和0.6molH2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol•L-1•min-1.
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量氮气
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1>K2(填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2B.v正(H2)=3v正(N2 )
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v正>v逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2molN2和0.6molH2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol•L-1•min-1.
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量氮气
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2B.v正(H2)=3v正(N2 )
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v正>v逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
7.现有下列药物,其中属于解热镇痛的药物是( )
| A. | 钡餐 | B. | 青霉素 | C. | 阿司匹林 | D. | 氢氧化铝 |
14.铝作为一种重要原料,在国民经济各部门、国防工业以及人们日常生活中得到广泛应用.下列关于铝的说法不正确的是( )
| A. | 银白色金属 | B. | 不与氧气反应 | ||
| C. | 能发生铝热反应 | D. | 能与氢氧化钠溶液反应 |
4.下列物质性质的比较中,正确的是( )
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |
8.下列离子方程式正确的是( )
| A. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O | |
| B. | 碳酸氢钠溶液中加盐酸 CO32-+2H+═CO2和H2O | |
| C. | 氢氧化钠溶液中加硫酸镁 2OH-+Mg2+═Mg(OH)2 | |
| D. | 氢氧化钡溶液中加硫酸 OH-+H+═H2O |
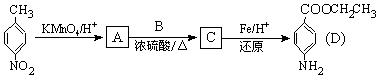
 、BCH3CH2OH、C
、BCH3CH2OH、C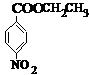 .
.
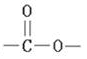
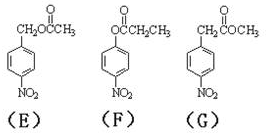
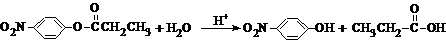 .
.

 的流程图(无机试剂任选).合成路线流程图示如图:
的流程图(无机试剂任选).合成路线流程图示如图: