题目内容
【题目】某同学在实验室制备SO2并对SO2的性质进行了探究。回答下列问题:
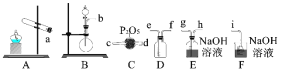
(1)制备SO2
①实验室中通常用亚硫酸钠与浓硫酸反应制备SO2气体。二氧化硫的发生装置可以选择上图中的_______,反应的化学方程式为____________。
②欲收集一瓶干燥的二氧化硫,选择上图中的装置,其连接顺序为:发生装置→_____________(按气流方向,用小写字母表示)。
(2)探究SO2的性质,用下图所示装置进行实验。

①实验过程中观察到装置A、B有如下现象:A中无变化,B中红色褪去。由此得出的实验结论是___________________。
②装置C、D中发生的现象分别是______________________、_____________________,这些现象分别说明SO2具有的性质是___________和__________;装置D中发生反应的离子方程式为_____________。
③装置E中含酚酞的NaOH溶液逐渐褪色,此实验现象有两种解释:一是由于SO2有漂白性;二是由于SO2溶于水后显酸性。请设计实验加以验证:___________。
【答案】B Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O d→c→e→f→i SO2在有水存在的情况下可以使品红溶液褪色 无色溶液中出现黄色浑浊 溶液由棕黄色变为浅绿色 氧化性 还原性 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 取装置E中褪色的溶液少许于试管,加入足量NaOH,若恢复原色,则褪色的原因是由于SO2的酸性导致;若不能恢复原色,则是由于SO2的漂白性所致
【解析】
(1)①实验室制备SO2装置:固、液不加热制气装置;
②欲收集一瓶干燥的二氧化硫,先依据反应原理进行制气,然后干燥、再收集,因为二氧化硫气体有毒,最后再进行尾气处理;
(2)①二氧化硫通入装置A、B,依据实验现象,作对比分析;
②探究二氧化硫的氧化性和还原性;
③二氧化硫通入含酚酞的NaOH溶液,溶液逐渐褪色,探究是二氧化硫的漂白性还是二氧化硫溶于水生成亚硫酸,然后酸碱发生中和反应所致,则可以反滴,即取褪色后的溶液,滴加较浓的NaOH溶液,若变红,则证明褪色是由于SO2溶于水显酸性导致的。
(1)①实验室制备SO2反应类型为:固+液→气体,发生装置选B,反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
②欲收集一瓶干燥的二氧化硫,发生装置生成二氧化硫,C装置中的P2O5干燥SO2,用D装置收集SO2,因为SO2的密度比空气的密度大,长导管e进气,短导管f出气,SO2有毒,用F装置的氢氧化钠溶液吸收,故欲收集一瓶干燥的二氧化硫,其连接顺序为:发生装置→d→c→e→f→i;
(2)①甲同学进行对照实验,一种有水,一种没有水,实验的目的是探究SO2使品红褪色共存是否有水参与,故SO2在有水存在的情况下可以使品红溶液褪色;
②当二氧化硫通入硫化钠溶液中,无色溶液中出现黄色浑浊,二氧化硫具有氧化性;当二氧化硫通入氯化铁溶液中,发生氧化还原反应,生成氯化亚铁,溶液颜色由棕黄色变为浅绿色,二氧化硫具有还原性。装置D中反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
③要证明SO2具有漂白性还是其溶于水显酸性,则可以反滴,即取褪色后的溶液,滴加较浓的NaOH溶液,若变红,则证明褪色是由于SO2溶于水显酸性导致的。

 名师伴你成长课时同步学练测系列答案
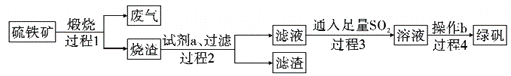
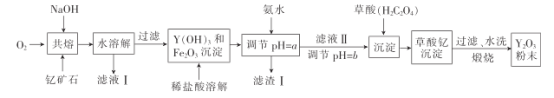
名师伴你成长课时同步学练测系列答案【题目】氧化钇主要用于制造微波磁性材料、军工材料、光学玻璃和显像管涂料等。工业上通过如下工艺流程用钇矿石(Y2 FeBe2 Si2O10,Y的化合价为+3)制取氧化钇。
已知:i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)用氧化物的形式表示Y2 FeBe2 Si2O10为___, 钇矿石在熔融前要粉碎,目的是___。
(2)共熔时通人氧气的作用是_________。
(3)滤液I中溶质的主要成分是___ ( 假设钇矿石恰好与NaOH完全反应)。
(4)用氨水调节pH=a时,a的取值范围是_____,设计实验证明滤渣I沉淀完全: _______________。
(5)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式:_____________。
【题目】元素锰(Mn)在溶液中主要以Mn2+(近无色)、MnO4-(紫红色)、MnO42-(绿色)等形式存在,MnO2(棕黑色)、MnCO3(白色)为难溶于水的固体。回答下列问题:
(1)盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法推算。现根据下列3个热化学反应方程式:
①MnO2(s)+CO(g)=MnO(s)+CO2(g) H=﹣150.6kJ/mol
②Mn3O4(s)+CO(g)=3MnO(s)+CO2(g) H=﹣54.4kJ/mol
③3Mn2O3v+CO(g)=2Mn3O4(s)+CO2(g) H=﹣142.3kJ/mol
写出CO气体还原MnO2固体得到Mn2O3固体和CO2气体的热化学反应方程式:_________
(2)①一定温度下,在5L的密闭容器中放入足量碳酸锰(固体所占体积忽略不计)发生反应:MnCO3(s)![]() MnO(s)+CO2(g),若前2min 内生成MnO的质量为7.1 g,则该段时间内v(CO2)=____________mol·L-1·min-1。
MnO(s)+CO2(g),若前2min 内生成MnO的质量为7.1 g,则该段时间内v(CO2)=____________mol·L-1·min-1。
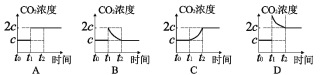
②保持温度不变,若t0时刻达到平衡时,CO2浓度为cmol/L;t1时刻,将容器体积缩小为原来的一半并固定不变,在t2时刻再次达到平衡,则下列图像正确的是_____(填字母)。
(3)已知Fe3+、Al3+、Mn2+的氢氧化物开始沉淀及沉淀完全时的pH如下表所示,当Al3+完全沉淀时,若要使Mn2+不沉淀,则Mn2+的最大浓度为_______________。(已知:Ksp[Mn(OH)2] = 1.9×1013)
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
开始沉淀pH | 1.8 | 4.1 | 8.3 |
完全沉淀pH | 3.2 | 5.0 | 9.8 |
(4)高锰酸钾在不同的条件下发生的反应如下:
MnO4-+5e-+8H+==Mn2++4H2O
MnO4-+3e-+2H2O==MnO2↓+4OH-;
MnO4-+e-==MnO42-
①从上述三个半反应中可以得出的结论是_______________。
②将SO2通入高锰酸钾溶液中,观察到的现象是________。
(5)向酸性高锰酸钾溶液中加入草酸溶液,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是_______________,写出反应的离子方程式____________________。