题目内容
【题目】草酸(![]() )广泛存在于食品中,人们对其及相关产品进行了深入研究。
)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1)已知![]() 时,
时,![]() :
:![]() ,
,![]() 溶液显酸性。解释
溶液显酸性。解释![]() 溶液显酸性的原因:______;(用化学用语并配以必要文字说明)
溶液显酸性的原因:______;(用化学用语并配以必要文字说明)
(2)已知反应:![]() ,为了使草酸分解,通过
,为了使草酸分解,通过![]() 燃烧反应提供能量:
燃烧反应提供能量:![]() ,已知分解的草酸与所需空气(其中氧气的体分数为
,已知分解的草酸与所需空气(其中氧气的体分数为![]() )的物质的量之比为
)的物质的量之比为![]() ,则
,则![]() ______
______
(3)草酸分解生成的![]() 燃料燃烧不足以提供足够的能量,还可通过甲烷来制备
燃料燃烧不足以提供足够的能量,还可通过甲烷来制备![]() 。在密闭容器中通入物质的量浓度均为
。在密闭容器中通入物质的量浓度均为![]() 的
的![]() 和
和![]() ;在一定条件下发生反应
;在一定条件下发生反应![]() ,测得
,测得![]() 的平衡转化率与温度、压强的关系如下图1所示。
的平衡转化率与温度、压强的关系如下图1所示。

①由图判断压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的顺序为:______;该反应的
由小到大的顺序为:______;该反应的![]() ______0(填“<”“>”“=”):
______0(填“<”“>”“=”):
②![]() 该反应的平衡常数为______(结果保留两位小数)
该反应的平衡常数为______(结果保留两位小数)
(4)常温下,向![]() 的
的![]() 溶液中逐滴加入
溶液中逐滴加入![]()
![]() 溶液,所得滴定曲线如图所示。下列说法正确的是______
溶液,所得滴定曲线如图所示。下列说法正确的是______
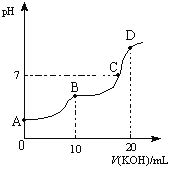
①![]() 点时:
点时:![]()
②![]() 点时:
点时:![]()
③![]() 点时:
点时:
④![]() 点时:
点时:![]()
【答案】NaHC2O4溶液存在电离平衡:HC2O4-![]() H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O
H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O![]() H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于HC2O4-的水解程度,溶液显酸性 169.8 p4 >p3>p2>p1 > 6.55 ②③
H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于HC2O4-的水解程度,溶液显酸性 169.8 p4 >p3>p2>p1 > 6.55 ②③
【解析】
(1)根据电离平衡常数计算HC2O4-的水解平衡常数,NaHC2O4溶液中HC2O4-电离程度大于其水解程度,溶液显酸性;
(2)草酸与所需空气(其中氧气的体分数20%)的物质的量之比为2:3,假设草酸为2mol,氧气为3mol×1/5=0.6mol;根据能量守恒关系列方程求解;
(3)①温度相同时,压强增大,平衡向逆反应方向移动,甲烷的转化率变小,由此判定压强大小顺序;压强不变,升高温度,甲烷的转化率增大,平衡右移,正反应为吸热反应;
②根据三段式求出平衡时各物质的浓度,以此求出该反应的平衡常数K。
(4)①A点时,为草酸溶液,溶液中存在电荷守恒;② B点时等物质的量的H2C2O4和KOH恰好反应生成KHC2O4;③![]() 点时:溶液呈中性,c(H+)=c(OH-),溶质为草酸钾和草酸氢钾的混合液,结合电荷守恒、物料守恒进行分析;④
点时:溶液呈中性,c(H+)=c(OH-),溶质为草酸钾和草酸氢钾的混合液,结合电荷守恒、物料守恒进行分析;④![]() 点时溶液为草酸钾,据以上情况进行分析。
点时溶液为草酸钾,据以上情况进行分析。
(1)NaHC2O4溶液中存在电离平衡:HC2O4-![]() H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O
H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O![]() H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于水解程度,溶液显酸性;
H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于水解程度,溶液显酸性;
综上所述,,本题答案是:NaHC2O4溶液存在电离平衡:HC2O4-![]() H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O
H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O![]() H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于HC2O4-的水解程度,溶液显酸性;
H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于HC2O4-的水解程度,溶液显酸性;
(2)已知分解的草酸与所需空气(其中氧气的体分数为![]() )的物质的量之比为2:3,假设草酸为2mol,则氧气为3mol×1/5=0.6mol;根据能量守恒关系可知:2×a=0.6×566,a=169.8;
)的物质的量之比为2:3,假设草酸为2mol,则氧气为3mol×1/5=0.6mol;根据能量守恒关系可知:2×a=0.6×566,a=169.8;
综上所述,本题答案是:169.8。
(3)①温度相同时,压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故p4 >p3>p2>p1;压强不变,升高温度,甲烷的转化率增大,平衡右移,正反应为吸热反应,H>0;
综上所述,本题答案是:p4 >p3>p2>p1;>。
②1100℃时,甲烷的转化率为80%,根据![]() 反应可知,剩余甲烷气体的浓度为0.2mol/L-0.2mol/L×80%=0.04mol/L,二氧化碳气体的浓度为0.2mol/L-0.2mol/L×80%=0.04mol/L,生成一氧化碳气体的浓度为2×0.2mol/L×80%=0.32mol/L,生成氢气气体的浓度为2×0.2mol/L×80%=0.32mol/L,所以该反应的平衡常数K=c2(H2)c2(CO)/[c(CH4)c(CO2)],带入数值计算可得:K=6.55;
反应可知,剩余甲烷气体的浓度为0.2mol/L-0.2mol/L×80%=0.04mol/L,二氧化碳气体的浓度为0.2mol/L-0.2mol/L×80%=0.04mol/L,生成一氧化碳气体的浓度为2×0.2mol/L×80%=0.32mol/L,生成氢气气体的浓度为2×0.2mol/L×80%=0.32mol/L,所以该反应的平衡常数K=c2(H2)c2(CO)/[c(CH4)c(CO2)],带入数值计算可得:K=6.55;
综上所述,本题答案是:6.55。
(4)①A点时,为草酸溶液,溶液中存在电荷守恒:c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),错误;
② B点时等物质的量的H2C2O4和KOH恰好反应生成KHC2O4,溶液的pH小于7,说明KHC2O4溶液呈酸性,溶液中离子浓度大小关系为:c(K+)>c(HC2O4-)>c(H+)>c(OH-),正确;
③C点时:溶液呈中性,c(H+)=c(OH-),结合电荷守恒得c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+ c(OH-),所以c(K+)=c(HC2O4-)+2c(C2O42-);根据物料守恒可知,如果全为草酸氢钾溶液:c(K+)= c(HC2O4-)+c(C2O42-)+ c(H2C2O4);如果全为草酸钾溶液,c(K+)= 2[c(HC2O4-)+c(C2O42-)+ c(H2C2O4)];而题给混合液呈中性,为草酸氢钾和草酸钾的混合液,因此溶液中存在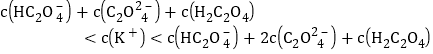 ;正确;
;正确;
④D点时:D点时,氢氧化钾的物质的量是草酸的2倍,二者恰好反应生成草酸钾,根据质子守恒:c(H+)+ c(HC2O4-)+2 c(C2O42-)=c(OH-),错误;综上所述,本题选②③。