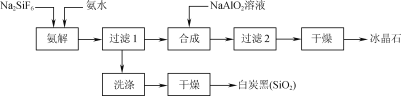
题目内容
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
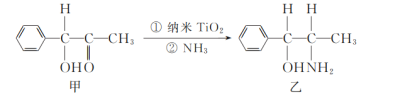
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
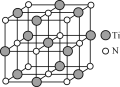
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
【答案】1s22s22p62s23p63d2或[Ar]3d2 NH4+ Ti<B<H 5 16mol Ti4CN3
【解析】
(1)①钛是22号元素,Ti2+核外有20个电子;②BH4-含有5个原子,价电子总数为8,据此分析书写与BH4-互为等电子体的阳离子;③根据第一电离能的变化规律分析判断H、B、Ti原子的第一电离能的大小顺序;
(2)采取sp3杂化方式的原子的价层电子对数=4,据此分析判断分子中采取sp3杂化方式的原子个数;
(3) 配位键属于σ键,1个单键为1个σ键,据此分析判断;
(4)根据均摊法计算晶胞中碳、氮、钛原子数目,进而确定化学式。
(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为:1s22s22p63s23p63d2,故答案为:1s22s22p63s23p63d2;
②BH4-含有5个原子,价电子总数为8,与BH4-互为等电子体的阳离子为NH4+,故答案为:NH4+;
③同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素。同族元素,从上至下第一电离能逐渐减小,金属元素的第一电离能小于非金属元素,H、B、Ti原子的第一电离能由小到大的顺序为Ti<B<H,故答案为:Ti<B<H;
(2)化合物乙( )的分子中采取sp3杂化方式的原子个数有
)的分子中采取sp3杂化方式的原子个数有 (标记为●的原子采取sp3杂化),共5个,故答案为:5;
(标记为●的原子采取sp3杂化),共5个,故答案为:5;
(3) 1个[Ti(OH)2(H2O)4]2+中含有6个配位键,10个O-H,因此1mol[Ti(OH)2(H2O)4]2+中含有σ键的数目为16mol,故答案为:16mol;
(4) 某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞顶点的氮原子,利用均摊法可知,晶胞中含有碳原子数为8×![]() =1,含有氮原子数为6×
=1,含有氮原子数为6×![]() =3,含有钛原子数为12×
=3,含有钛原子数为12×![]() +1=4,所以碳、氮、钛原子数之比为1∶3∶4,则该化合物的化学式为Ti4CN3,故答案为:Ti4CN3。
+1=4,所以碳、氮、钛原子数之比为1∶3∶4,则该化合物的化学式为Ti4CN3,故答案为:Ti4CN3。

 阅读快车系列答案
阅读快车系列答案【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
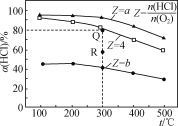
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1