题目内容
18.洗煤和选煤过程中排出的煤矸石(主要含Al2O3、SiO2及Fe2O3)会占用大片土地,造成环境污染.某课题组利用煤矸石制备聚合氯化铝流程如下:
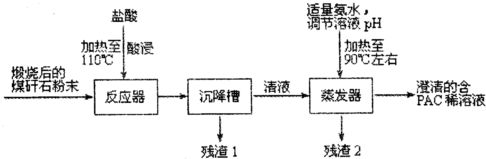
已知:聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂.
(1)酸浸的目的是将煤矸石中的Al2O3及Fe2O3溶解,与SiO2分离;实验需要 的500mL3.0mol•L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有500mL容量瓶、胶头滴管.
(2)若m=n=2,则生成PAC的化学方程式是4AlCl3+4NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4NH4Cl
(或4AlCl3+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4HCl).
(3)从含PAC的稀溶液中获得PAC固体的实验操作方法是蒸发浓缩、冷却结晶、过滤.
(4)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2 mol•L-1KmnO4标准溶液滴定,消耗标准溶液20.00mL.已知反应式为Fe2++MnO4-+H+-Fe3++Mn2++H2O(未配平).判断滴定终点的依据是滴入最后一滴高锰酸钾溶液时,溶液出现紫红色且在半分钟内不褪;残渣2中铁元素的质量分数为4.480%.
分析 煤矸石(主要含Al2O3、SiO2及Fe2O3)中加入稀盐酸并加热,发生的反应为Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2不溶于稀盐酸,然后过滤得到的滤渣1中成分为SiO2,滤液中溶质为AlCl3、FeCl3,向滤液中加入适量氨水溶液并加热,发生反应4AlCl3+4NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4NH4Cl(或4AlCl3+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4HCl)、FeCl3+3NH3.H2O=Fe(OH)3↓+3NH4Cl,过滤得到滤渣2为Fe(OH)3,滤液中成分为[Al2(OH)2Cl4]2、NH4Cl,
(1)酸浸的目的是将氧化铝和氧化铁与二氧化硅分离;实验需要的500mL3.0mol•L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有500mL容量瓶、胶头滴管;
(2)若m=n=2,聚合氯化铝([Al2(OH)nCl6-n]m的化学式为聚合氯化铝([Al2(OH)2Cl4]2,氯化铝和一水合氨反应生成PAC和氯化铵;
(3)从溶液中获取固体采用蒸发浓缩、冷却结晶、过滤、洗涤方法;
(4)Fe2++MnO4-+H+-Fe3++Mn2++H2O中Fe元素化合价由+2价变为+3价、Mn元素化合价由+7价变为+2价,转移电子数为5,离子反应方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,根据亚铁离子和高锰酸钾的关系式计算亚铁离子的物质的量,铁元素质量=nM,从而计算其质量分数;滴定终点为滴入最后一滴高锰酸钾溶液时,溶液出现紫红色且在半分钟内不褪.
解答 解:煤矸石(主要含Al2O3、SiO2及Fe2O3)中加入稀盐酸并加热,发生的反应为Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2不溶于稀盐酸,然后过滤得到的滤渣1中成分为SiO2,滤液中溶质为AlCl3、FeCl3,向滤液中加入适量氨水溶液并加热,发生反应4AlCl3+4NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4NH4Cl(或4AlCl3+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4HCl)、FeCl3+3NH3.H2O=Fe(OH)3↓+3NH4Cl,过滤得到滤渣2为Fe(OH)3,滤液中成分为[Al2(OH)2Cl4]2、NH4Cl,
(1)氧化铁、氧化铝都溶于稀盐酸,二氧化硅不溶于稀盐酸,所以酸浸的目的是将氧化铝和氧化铁与二氧化硅分离;实验需要的500mL3.0mol•L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有500mL容量瓶、用于定容的胶头滴管,
故答案为:将煤矸石中的Al2O3及Fe2O3溶解,与SiO2分离;
(2)若m=n=2,聚合氯化铝([Al2(OH)nCl6-n]m的化学式为聚合氯化铝([Al2(OH)2Cl4]2,
氯化铝和一水合氨反应生成PAC和氯化铵,反应方程式为4AlCl3+4NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4NH4Cl(或4AlCl3+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4HCl),
故答案为:4AlCl3+4NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4NH4Cl(或4AlCl3+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Al2(OH)2Cl4]2+4HCl);
(3)从溶液中获取固体采用蒸发浓缩、冷却结晶、过滤、洗涤方法,故答案为:蒸发浓缩;冷却结晶;过滤;
(4)Fe2++MnO4-+H+-Fe3++Mn2++H2O中Fe元素化合价由+2价变为+3价、Mn元素化合价由+7价变为+2价,转移电子数为5,离子反应方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,根据亚铁离子和高锰酸钾的关系式得n(Fe2+)=$\frac{1.000×1{0}^{-2}mol/L×0.020L}{1}×5$=1×10-3 mol,100mL溶液中n(Fe2+)=1×10-3 mol×4=4×10-3 mol,铁元素质量=nM=4×10-3 mol×56g/mol=0.224g,Fe元素质量分数=$\frac{0.224g}{5.000g}×100%$=4.480%;滴定终点为滴入最后一滴高锰酸钾溶液时,溶液出现紫红色且在半分钟内不褪,
故答案为:滴入最后一滴高锰酸钾溶液时,溶液出现紫红色且在半分钟内不褪;4.480%.
点评 本题考查物质分离和提纯,为高频考点,涉及氧化还原反应及其计算、基本操作、仪器选取等知识点,明确实验原理是解本题关键,知道流程图中发生的反应及基本操作,注意选取容量瓶要注明规格,题目难度中等.

①乙烯 ②甲烷 ③乙苯 ④乙炔 ⑤苯酚 ⑥甲苯 ⑦苯 ⑧乙醇.
| A. | ②③④⑥ | B. | ②③④⑤⑥⑦⑧ | C. | ②④⑦ | D. | ②⑦ |
| A. | 主族元素分布于短周期和长周期里,而副族元素仅分布于长周期里 | |
| B. | 元素周期表中,位于同一主族的元素的原子最外层电子数相同,且等于族序数 | |
| C. | 元素周期表中,周期的序数就是该周期元素原子具有的电子层数 | |
| D. | 元素周期表有7个横行,7个周期;18个纵列,18个族 |
| A. | 2 mL 0.5 mol/L硅酸钠溶液中滴入盐酸所制得的硅酸胶体中,含胶粒数目为0.001NA | |
| B. | 8.4 g NaHCO3固体中含有的离子总数为0.3NA | |
| C. | 25℃时,1 L pH=l的CH3COOH溶液中含有H+数目为0.lNA | |
| D. | 7.8 g Na2O2固体中含有的共用电子对数目为0.2NA |
| A. | 常温常压下,28gCH2=CH2含有NA个碳原子 | |
| B. | 1mol苯含有3NA个碳碳单键和3NA个碳碳双键 | |
| C. | 标准状况下,22.4L正戊烷含有12NA个氢原子 | |
| D. | 常温常压下,16gCH4含有4NA个共价键 |
 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )| A. | R的一种单体的分子式可能为C9H10O2 | |
| B. | R完全水解后生成物均为小分子有机物 | |
| C. | 可以通过加聚反应和缩聚反应合成R | |
| D. | 碱性条件下,1 mol R完全水解消耗NaOH的物质的量为2 mol |
| A. | CO2的结构式O-C-O | |
| B. | S2-的结构示意图 | |
| C. | N2的电子式为  | |
| D. | 质子数为53,中子数为78的碘原子${\;}_{53}^{78}$I |
 .
.