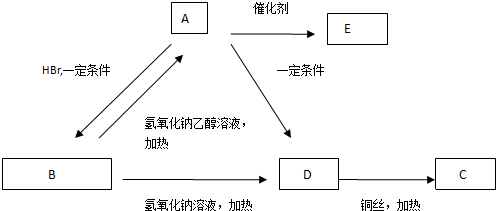
题目内容
锂电池消耗量巨大,这对不可再生的金属资源消耗是相当大的.因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂.某回收工艺流程如图:
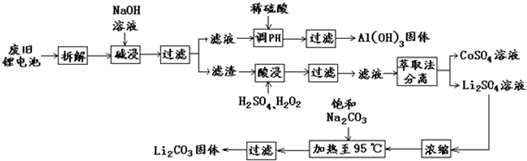
(1)上述工艺回收到的产物有Al(OH)3、 (填化学式);其中生成Al(OH)3的离子方程式为 .
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全,对拆解环境的要求是 .
(3)酸浸时如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处 是 .
(4)生成Li2CO3的化学反应方程式为 .已知 Li2CO3在水中的溶解度随着温度的升高而减小,所以在浓缩结晶后的一步操作是 .进行该步操作有时采用如图装置进行.下列关于使用该装置的说法错误的是
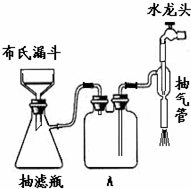
a.用玻璃棒轻轻搅动漏斗中液体,以加快过滤
b.过滤结束后,先关掉水龙头停止抽气,再取掉抽滤瓶的橡胶接管
c.与普通过滤相比,该过滤操作除了能加快过滤速度,还可以得到更加干燥的沉淀
d.A瓶是安全瓶,主要是起防倒吸的作用
(5)现有一种新型锂离子电池,是将尖晶石型Li4Ti5O12作为电池的正极材料.在嵌锂过程过程中变为盐岩型Li7Ti5O12.该锂离子电池放电时的负极反应式为 .充电时的阳极反应式为 .

(1)上述工艺回收到的产物有Al(OH)3、
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全,对拆解环境的要求是
(3)酸浸时如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处 是
(4)生成Li2CO3的化学反应方程式为

a.用玻璃棒轻轻搅动漏斗中液体,以加快过滤
b.过滤结束后,先关掉水龙头停止抽气,再取掉抽滤瓶的橡胶接管
c.与普通过滤相比,该过滤操作除了能加快过滤速度,还可以得到更加干燥的沉淀
d.A瓶是安全瓶,主要是起防倒吸的作用
(5)现有一种新型锂离子电池,是将尖晶石型Li4Ti5O12作为电池的正极材料.在嵌锂过程过程中变为盐岩型Li7Ti5O12.该锂离子电池放电时的负极反应式为
考点:物质分离和提纯的方法和基本操作综合应用,原电池和电解池的工作原理
专题:实验设计题,电化学专题
分析:(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)从金属锂的化学性质分析,锂为活泼金属;
(3)由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成;
(4)根据质量守恒定律来书写化学方程式,Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤;
a.过滤时不能搅拌;
b.先取掉抽滤瓶的橡胶接管,再关掉水龙头停止抽气;
c.抽滤速度比普通过滤速度要快,得到的固体较干燥;
d.A瓶能防止液体倒吸到抽滤瓶中;
(5)Li失电子为负极;充电时阳极上Li7Ti5O12得电子.
(2)从金属锂的化学性质分析,锂为活泼金属;
(3)由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成;
(4)根据质量守恒定律来书写化学方程式,Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤;
a.过滤时不能搅拌;
b.先取掉抽滤瓶的橡胶接管,再关掉水龙头停止抽气;
c.抽滤速度比普通过滤速度要快,得到的固体较干燥;
d.A瓶能防止液体倒吸到抽滤瓶中;
(5)Li失电子为负极;充电时阳极上Li7Ti5O12得电子.
解答:
解:(1)工艺流程的最终产物为:Al(OH)3、CoSO4、Li2CO3,故答案为:CoSO4、Li2CO3;
(2)金属锂性质活泼,易与氧气、水发生反应,故答案为:隔绝空气和水分;
(3)由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,故答案为:有氯气生成,污染较大;
(4)碳酸锂难溶,生成Li2CO3的化学反应属于复分解反应,其反应的热化学方程式为Li2SO4+Na2CO3=Na2SO4+Li2CO3↓,Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤;
a.滤纸容易破损,所以过滤时不能搅拌,故a错误;
b.先取掉抽滤瓶的橡胶接管,再关掉水龙头停止抽气,若先关掉水龙头停止抽气,再取掉抽滤瓶的橡胶接管,容易倒吸,故b错误;
c.抽滤速度比普通过滤速度要快,得到的固体较干燥,故c正确;
d.A瓶能防止液体倒吸到抽滤瓶中,则A瓶主要是起防倒吸的作用,故d正确;
故答案为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;趁热过滤;ab;
(5)Li失电子为负极,则负极的电极反应为Li-e-=Li+;充电时阳极上Li7Ti5O12得电子,则阳极的电极反应为:Li7Ti5O12-3e-=Li4Ti5O12+3 Li+;
故答案为:Li-e-=Li+;Li7Ti5O12-3e-=Li4Ti5O12+3 Li+.
(2)金属锂性质活泼,易与氧气、水发生反应,故答案为:隔绝空气和水分;
(3)由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,故答案为:有氯气生成,污染较大;
(4)碳酸锂难溶,生成Li2CO3的化学反应属于复分解反应,其反应的热化学方程式为Li2SO4+Na2CO3=Na2SO4+Li2CO3↓,Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤;
a.滤纸容易破损,所以过滤时不能搅拌,故a错误;
b.先取掉抽滤瓶的橡胶接管,再关掉水龙头停止抽气,若先关掉水龙头停止抽气,再取掉抽滤瓶的橡胶接管,容易倒吸,故b错误;
c.抽滤速度比普通过滤速度要快,得到的固体较干燥,故c正确;
d.A瓶能防止液体倒吸到抽滤瓶中,则A瓶主要是起防倒吸的作用,故d正确;
故答案为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;趁热过滤;ab;
(5)Li失电子为负极,则负极的电极反应为Li-e-=Li+;充电时阳极上Li7Ti5O12得电子,则阳极的电极反应为:Li7Ti5O12-3e-=Li4Ti5O12+3 Li+;
故答案为:Li-e-=Li+;Li7Ti5O12-3e-=Li4Ti5O12+3 Li+.
点评:本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,本题难度中.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗xmolH2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol?L-1为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列说法正确的是( )
| A、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B、铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| C、其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D、能与酸反应的氧化物,一定是碱性氧化物 |