题目内容
【题目】CH4和CO2反应可以制造价值更高的化学产品.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
物质 | CH4 | CO2 | CO | H2 |
平衡浓度mol/L | 0.5 | 0.5 | 2.0 | 2.0 |
①此温度下,该反应的平衡常数K=______注明单位.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1
2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=______ kJmol-1
2CO(g)+2H2(g)的ΔH=______ kJmol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4![]() CH3COOH,请回答:
CH3COOH,请回答:
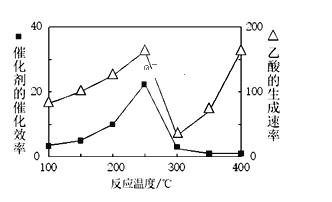
①温度与催化剂的催化效率和乙酸的生成速率如图250~300℃时,温度升高而乙酸的生成速率降低的原因是______
②为提高上述反应CH4的转化率,可采取的措施有______(写2种)
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为______,每消耗3molCu2Al2O4时被还原的HNO3为______mol
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2,原理是:500℃时, CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2, Li4SiO4再生,该原理的化学方程式______.
【答案】64mol2L-2 △H1-2△H3+2△H2 温度在250~300℃时,催化剂的催化效率降低 增大反应压强、增大CO2的浓度 Cu 2 ac CO2+Li4SiO4![]() Li2CO3+Li2SiO3
Li2CO3+Li2SiO3
【解析】
(1) ①根据K=![]() 计算;
计算;
②根据盖斯定律计算;
(2)①催化剂的活性降低,导致温度升高而乙酸的生成速率降低;
②根据方程式,增大压强,或增大CO2的浓度,可使平衡正向进行;
③被还原HNO3为化合价降低的硝酸;
(3)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质;
b.Li2O、Na2O、MgO都没有强氧化性,则吸收二氧化碳与氧化还原无关;
c.Li2O、Na2O、MgO均能吸收CO2,锂、钠、镁为ⅠA、ⅡA族元素,可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3。
(1) ①K=![]() =
=![]() =64mol2L-2;
=64mol2L-2;
②①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1,②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1,③2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1,根据盖斯定律,①+2×②-2×③,即可得到CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g),则ΔH=△H1-2△H3+2△H2 kJmol-1;
2CO(g)+2H2(g),则ΔH=△H1-2△H3+2△H2 kJmol-1;
(2)①催化剂的活性降低,导致温度升高而乙酸的生成速率降低;
②根据方程式,增大压强,可使平衡正向进行,或增大CO2的浓度,也可使平衡正向进行,从而提高CH4的转化率。
③Cu2Al2O4中Cu的化合价为+1价,与硝酸反应时,变为+2价,被氧化;每消耗3molCu2Al2O4时,转移6mol电子,则硝酸的化合价由+5变为+2价,被还原HNO3为2mol;
(3)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,符合题意,a正确;
b.Li2O、Na2O、MgO都没有强氧化性,则吸收二氧化碳与氧化还原无关,与题意不符,b错误;
c.Li2O、Na2O、MgO均能吸收CO2,锂、钠、镁为ⅠA、ⅡA族元素,可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,符合题意,c正确;
答案为ac;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,则方程式为CO2+Li4SiO4![]() Li2CO3+Li2SiO3。
Li2CO3+Li2SiO3。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案