题目内容
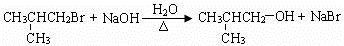
12.龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.Ⅰ.已知龙胆酸甲酯结构如图所示:
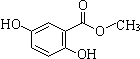
(1)龙胆酸甲酯的含氧官能团名称为酚羟基和酯基.
(2)下列有关龙胆酸甲酯的描述,不正确的是D(填字母).
A.不能发生消去反应 B.难溶于水
C.能与溴水反应 D.能与碳酸钠溶液反应产生二氧化碳
(3)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式是
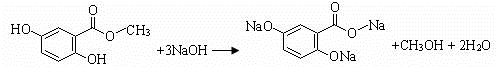 .(不用写反应条件)
.(不用写反应条件)Ⅱ.已知X及其他几种有机物存在如下转化关系,且测得A中含三个甲基:
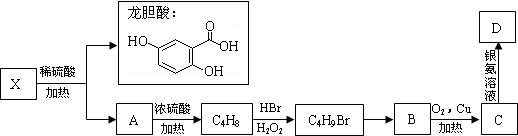
回答以下问题:
(4)X的结构简式为
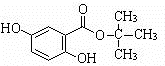 .
.(5)写出C4H9Br生成B的化学方程式
 .(用结构简式表示)
.(用结构简式表示)(6)写出满足下列条件的龙胆酸的一种同分异构体的结构简式
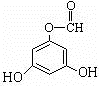 或
或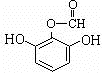 .
.①能发生银镜反应 ②能使FeCl3溶液显色 ③酯类 ④苯环上的一氯代物只有两种.
分析 Ⅰ.已知龙胆酸甲酯结构如图所示:
(1)龙胆酸甲酯的含氧官能团名称为酚羟基和酯基;
(2)A.含有酚羟基和酯基,能发生加成反应、氧化反应、水解反应但不能发生消去反应;
B.憎水基对溶解度影响能力大于亲水基;
C.含有酚羟基,且苯环上酚羟基邻位有氢原子,能和溴发生取代反应;
D.羧基能和碳酸氢钠反应;
(3)龙胆酸甲酯与足量氢氧化钠溶液反应,酚羟基、酯基水解生成的羧基都能和氢氧化钠反应;
Ⅱ.由X水解生成龙胆酸和A,A发生消去反应生成烯烃C4H8,C4H8为纯净物且含三个甲基,应为(CH3)2C=CH2,则A为(CH3)3COH或(CH3)2CHCH2OH,B即为(CH3)2CHCH2OH,C为(CH3)2CHCHO,D为(CH3)2CHCOOH,X为 ,结合题目分析解答.
,结合题目分析解答.
解答 解:(1)龙胆酸甲酯的含氧官能团名称为酚羟基和酯基,故答案为:酚羟基、酯基;
(2)A.含有酚羟基和酯基,能发生加成反应、氧化反应、水解反应但不能发生消去反应,故正确;
B.憎水基对溶解度影响能力大于亲水基,所以难溶于水,故正确;
C.含有酚羟基,且苯环上酚羟基邻位有氢原子,能和溴发生取代反应,故正确;
D.羧基能和碳酸氢钠反应,该物质中不含羧基,所以不和碳酸氢钠反应,故错误;
故选D;
(3)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式为 ,故答案为:
,故答案为: ;
;
II.由X水解生成龙胆酸和A,A发生消去反应生成烯烃C4H8,C4H8为纯净物且含三个甲基,应为(CH3)2C=CH2,则A为(CH3)3COH或(CH3)2CHCH2OH,B即为(CH3)2CHCH2OH,C为(CH3)2CHCHO,D为(CH3)2CHCOOH,则X为 ,
,
(4)X的结构简式为 ,故答案为:
,故答案为: ;
;
(5)C4H9Br和氢氧化钠水溶液共热发生取代反应生成B,该反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(6)①能发生银镜反应说明含有醛基;
②能使FeCl3溶液显色说明含有酚羟基;
③酯类含有酯基;
④苯环上的一氯代物只有两种,说明苯环上只有2种氢原子,符合条件的同分异构体结构简式为 或
或 ,
,
故答案为: 或
或 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系是解本题关键,结合反应条件、某些物质的分子式进行推断,难点是同分异构体结构简式确定,题目难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | X在一定条件下能发生水解、酯化、加成等反应 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.

①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| C | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O NaBr+NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:
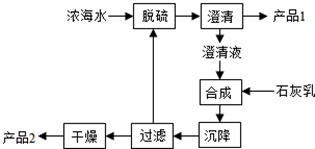
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式Mg+2H2O$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2+H2↑.
| A. | 在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 若pH>7,则一定是 c${\;}_{{1}_{\;}}$v1=c2v2 | |
| C. | 当pH=7时,若v1=v2,则一定是c2>c1 | |
| D. | 若v1=v2,c2=c1,则 c(CH3COO-)+c(CH3COOH)=c(Na+) |