题目内容
11.下列叙述正确的是( )| A. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| B. | 将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半 | |
| C. | 常温下,某溶液中由水电离出的c(OH-)=1×10-10 mol/L,该溶液可能是盐酸 | |
| D. | 如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)也是醋酸的两倍 |
分析 A、醋酸和盐酸都为一元酸,相同浓度和相同体积时反应NaOH的物质的量相同;
B、一水合氨是弱碱,存在电离平衡,加水稀释时氢氧根离子物质的量增大;
C、盐酸能够抑制水的电离;
D、醋酸是弱酸,存在电离平衡.
解答 解:A、中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需氢氧化钠相同,故A错误;
B、将氢氧化钠溶液稀释一倍,c(OH-)减少到原来的一半,而将氨水稀释一倍,c(OH-)减少不到原来的一半,故B错误;
C、盐酸能够抑制水的电离,某溶液中由水电离出的c(OH-)=1×10-10 mol/L,该溶液可能是盐酸,故C正确;
D、如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)小于醋酸的两倍,故D错误;
故选C.
点评 本题考查了强酸和弱酸中和NaOH的能力以及强酸弱酸加水稀释时离子浓度的变化、影响水的电离平衡移动的因素,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
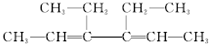
2.下列关于有机物 的说法不正确的是( )
的说法不正确的是( )
 的说法不正确的是( )
的说法不正确的是( )| A. | 所有的碳原子在同一个平面上 | |
| B. | 能够发生加成反应 | |
| C. | 不能发生消去反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |
19.新制氯水与久置氯水相比较,下列说法错误的是( )
| A. | 颜色不同 | B. | 都能使滴有酚酞的NaOH溶液褪色 | ||
| C. | 都能使有色布条褪色 | D. | 加AgNO3溶液都能生成白色沉淀 |
16.咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
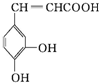

| A. | 该物质中苯环上一氯代物有2种 | |
| B. | 该分子结构中含有两种官能团 | |
| C. | 既能发生取代反应,也能发生加成反应 | |
| D. | 所有碳原子不可能都在同一个平面上 |
3.下列说法正确的是( )
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的物质一定是共价化合物 | |
| D. | 分子间作用力越大,分子的热稳定性就越大 |
20.根据如表提供的信息,下列判断错误的是( )
| 第一周期 |  | ||
| 第二周期 |  | 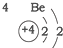 |  |
| 第三周期 | 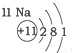 | 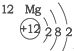 | 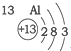 |
| A. | 元素所在的周期数等于其原子的电子层数 | |
| B. | 原子序数与元素原子核电荷数在数值上相同 | |
| C. | 第二、三周期元素的原子从左至右最外层电子数逐渐增多 | |
| D. | 金属元素的原子,其最外层电子数一般少于4个,在化学反应中易得到电子,趋向达到相对稳定结构 |