题目内容
7.下列热化学方程式或说法正确的是( )| A. | 甲烷的燃烧热为△H=-890 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
分析 A.水应该为液态;
B.合成氨为可逆反应,0.5 mol N2和1.5 mol H2没有完全反应就放出19.3 kJ热量,所以△H应该小于-38.6 kJ•mol-1;
C.氟化氢由气态变为液态会放出热量;
D.依据能量守恒定律和C项反应为放热反应可判断.
解答 解:A.水应该为液态,甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ•mol-1,故A错误;
B.合成氨为可逆反应,0.5 mol N2和1.5 mol H2没有完全反应就放出19.3 kJ热量,1molN2和3 mol H2完全反应就放出热量大于38.6 kJ,所以△H应该小于-38.6 kJ•mol-1,故B错误;
C.氟化氢由气态变为液态会放出热量,1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量应大于270 kJ,故C错误;
D.H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1为放热反应,说明2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和,故D正确,
故选:D.
点评 本题考查燃烧热、反应热有关计算、吸热反应与放热反应等,注意对燃烧热概念及热化学方程式的理解.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
17.下列涉及有机物的性质的说法错误的是( )
| A. | 苯不能使KMnO4溶液褪色,而甲苯使KMnO4溶液褪色 | |
| B. | 聚氯乙烯简称PVC,能够使溴的四氯化碳溶液褪色 | |
| C. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
18.核磁共振氢谱图上显示3个峰的是( )
| A. | (CH3)3CCH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CHCH2CH2CH3 |
15.分类是科学研究的重要方法,下列物质分类不正确的是( )
| A. | 非电解质:乙醇,氯气,乙酸 | |
| B. | 醇:甘油,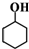 , ,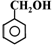 | |
| C. | 分子晶体:干冰,碘单质,蔗糖 | |
| D. | 混合物:铝热剂,聚乙烯,分析纯盐酸 |
2.下列实验操作方法正确的是( )
| A. | 在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡,再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基 | |
| B. | 将淀粉溶液与少量稀硫酸加热一段时间后,加入银氨溶液水浴加热,未析出银镜,说明淀粉未水解 | |
| C. | 用酒精清洗盛过苯酚的试管 | |
| D. | 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素 |
12.下列说法正确的是( )
| A. | 煤的干馏、石油的分馏都只发生了物理变化 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成了CO2和H2O | |
| C. | 甲烷和苯都能发生取代反应 | |
| D. | 乙醇和乙酸互为同分异构体 |
19.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )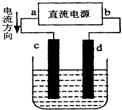

| A. | a为负极,c为阴极发生氧化反应 | |
| B. | 电子从电源的负极沿导线流入电解池的阴极 | |
| C. | 电解过程中,d电极:2Cl--2e-═Cl2↑ | |
| D. | 若反应过程中,有2.24 L 气体产生,则有0.2 mol电子发生转移 |
17.下列实验中没有颜色变化的是( )
| A. | 葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热 | |
| B. | 木板上涂抹浓硫酸 | |
| C. | 淀粉溶液中加入碘酒 | |
| D. | 苯加入到酸性高锰酸钾溶液中 |