题目内容
【题目】用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
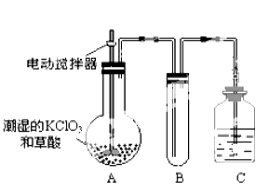
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请回答下列问题:
①A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
A部分还应添加温水浴控制60℃的温度,B部分还应补充什么装置: ;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 (填“A、B或C”)
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),该反应的离子方程式为 。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有 。
【答案】(1)ClO2、Cl2、Na2FeO4;
(2)①2KClO3+H2C2O4=K2CO3+2ClO2↑+CO2↑+H2O,盛有冰水混合物的水槽或冰水浴;②C;③2ClO2+2OH-= ClO2-+ClO3-+H2O;80.0;500ml容量瓶,烧杯。
【解析】
试题分析:(1)ClO2:ClO2→Cl-↓5,1g该物质得到电子物质的量为:5 / 67.5 mol ≈ 0.07mol,Na2FeO4:+6→+3↓3,1g该物质得到电子的物质的量为:3 / 166 mol ≈ 0.02 mol,Cl2:0→-1,1g该物质得到电子物质的量为2 / 71 mol ≈ 0.03 mol,因此消毒效率:ClO2 > Cl2 > Na2FeO4;
(2)①反应物有:KClO3和草酸,生成物为ClO2、CO2、K2CO3,根据化合价的升降法以及原子守恒,此反应方程式为2KClO3+H2C2O4=K2CO3+2ClO2↑+CO2↑+H2O,ClO2的沸点为11℃,装置B的作用收集ClO2,因此需要把B装置放入冰水浴中;②ClO2易溶于水,C装置没有防止倒吸,需要C装置加防倒吸装置,故选项C正确;③根据化合价的升降法进行配平,因此离子反应方程式为2ClO2+2OH-=ClO2-+ClO3-+H2O;实验室没有450mL的容量瓶,应选用500mL容量瓶,m(NaOH)=500×10-3×4×40g=80g;缺少的仪器有500mL容量瓶、烧杯。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案