题目内容
【题目】在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO转化率的变化、p2和195 ℃时n(H2)随时间的变化结果如图表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO转化率的变化、p2和195 ℃时n(H2)随时间的变化结果如图表所示。下列说法正确的是( )
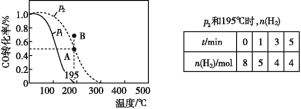
A.0~3 min,平均速率v(CH3OH)=0.8 mol·L-1·min-1
B.p1<p2,ΔH>0
C.在p2和195 ℃时,该反应的平衡常数为25( mol·L-1)-2
D.在B点时,v正>v逆
【答案】C
【解析】
A. B.0~3 min,n(H2)=8-4=4mol,故n(CH3OH)=4÷2=2mol,v(CH3OH)=![]() =0.033molL-1min-1,故A错误;
=0.033molL-1min-1,故A错误;
B.该反应是气体体积减小的反应,增大压强平衡正向移动,195℃时,CO转化率P2大于P1,压强从P1变到P2后平衡正向移动,因此P1到P2为增大压强,P1<P2,P1时,升高温度,CO转化率减小,平衡逆向移动,故正反应为放热反应,△H<0;故B错误;
C.由表中信息可知,起始时:c(H2)=8mol/20L=0.4mol/L,c(CO)=1/2c(H2)=0.2mol/L;平衡时:c(H2)=4mol/20L=0.2mol/L;

![]() =25( mol·L-1)-2,故C正确;
=25( mol·L-1)-2,故C正确;
D.根据表中数据知,平衡时氢气转化率为50%,当可逆反应中初始反应物物质的量之比等于其计量数之比时,其反应物转化率相等,所以该温度和压强下CO的转化率为50%,根据图知,A点是平衡状态,B点转化率大于A点,该反应在该温度和压强下达到平衡状态,应该向逆反应方向移动,所以B点v(正)<v(逆),故D错误;
故答案为C。

【题目】用活性炭还原法可以处理氮氧化物。如反应:![]()
![]() 。在
。在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
(1)T1℃时,该反应的平衡常数![]() ______
______
(2)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______ ![]() 答一种即可
答一种即可![]()
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/molS(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
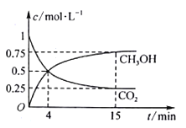
①0~4min,H2的平均反应速率v(H2)=________mol·L1·min1。
②CO2平衡时的体积分数为______________,该温度下Kp为_________kPa-2_(用含有p0的式子表示,小数点后保留1位)。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L1 | C1 | C2 |
则乙容器中反应起始向________(填“正反应”或“逆反应”)方向进行;c1_________(填“>”“<”或“=”)c2。