题目内容
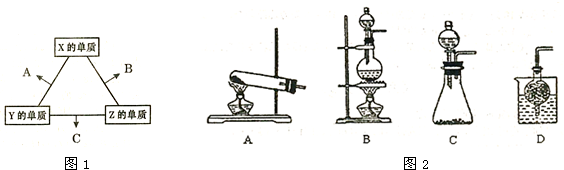
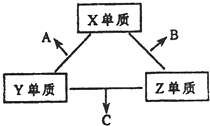 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在
(3)①C在一定条件下反应生成A的化学方程式是
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐.该盐的水溶液pH<7,其原因是(写出离子方程式)
分析:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3,且一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,据此解答.
解答:解:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3,且一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,
(1)O元素的质子数为8,氧原子有2个电子层,最外层电子数为6,位于第二周期VIA族,
故答案为:第二周期VIA族;
(2)H2O分子之间存在氢键、NH3分子之间存在氢键,氢键的作用大于范德华力,故沸点高于同主族其它氢化物沸点,
故答案为:氢键;
(3)①NH3在一定条件下反应生成A的化学方程式是:4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O;
②O、N、H三种元素可组成一种强酸为HNO3,NH3在适当条件下被HNO3吸收生成一种盐为NH4NO3,该盐的水溶液中NH4+离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,故pH<7,
故答案为:NH4++H2O?NH3?H2O+H+.
(1)O元素的质子数为8,氧原子有2个电子层,最外层电子数为6,位于第二周期VIA族,
故答案为:第二周期VIA族;
(2)H2O分子之间存在氢键、NH3分子之间存在氢键,氢键的作用大于范德华力,故沸点高于同主族其它氢化物沸点,
故答案为:氢键;
(3)①NH3在一定条件下反应生成A的化学方程式是:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
②O、N、H三种元素可组成一种强酸为HNO3,NH3在适当条件下被HNO3吸收生成一种盐为NH4NO3,该盐的水溶液中NH4+离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,故pH<7,
故答案为:NH4++H2O?NH3?H2O+H+.
点评:本题考查位置结构性质的关系等,推断该题的突破口为X、Y、Z三种短周期元素的单质为无色气体,再结合信息与转化关系推断,题目难度中等.

练习册系列答案
相关题目