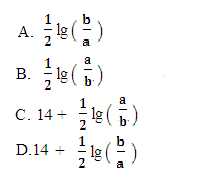题目内容
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表,下列判断不正确的是
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) = Kw/10-9mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
B
解析

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列说法中,正确的是
| A.已知25℃时NH4CN水溶液显碱性,则25℃时的电离常数K(NH3·H2O)>K(HCN) |
| B.25℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| C.pH试纸测得新制氯水的pH为4.5 |
| D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法错误的是( )
| A.溶液中导电粒子的数目增加 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,但电离平衡常数Ka不变 |
| D.再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
室温下,下列关于pH均为9、体积均为10 mL的NaOH溶液和CH3COONa溶液的说法,正确的是
| A.两种溶液中的c(Na+)相等 |
| B.分别加热到相同温度时,CH3COONa溶液的pH小 |
| C.分别加水稀释到100 mL时,两种溶液的pH依然相等 |
| D.两溶液中由水电离出的c(OH-)之比为10-9/10-5 |
相同温度下,在水中分别加入下列物质,若用Kw表示水的离子积,a表示水的电离程度,能使a/Kw的值增大的是
| A.NaOH | B.NaHSO4 | C.HC1 | D.NH4NO3 |
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是
| A.②中由水电离出的c(H+)=1×10-12mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中正确的是
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(
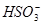 )>c(
)>c(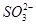 )>c(OH-)
)>c(OH-)  M2+(aq)+2OH-(aq),Ksp =a,c(M2+)=bmol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq),Ksp =a,c(M2+)=bmol·L-1时,溶液的pH等于