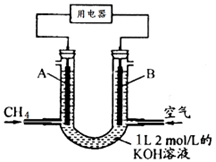
题目内容
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法错误的是( )
| A.溶液中导电粒子的数目增加 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,但电离平衡常数Ka不变 |
| D.再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
D
解析试题分析:在醋酸溶液存在电离平衡:CH3COOH CH3COO-+H+ A。若加入水,则c(CH3COO-)、c(CH3COOH)、c(H+)的浓度都减小。由于电离产生的离子的浓度减小的多,所以电离平衡正向移动。所以溶液中导电粒子的数目增加。正确。B。因此c(CH3COOH)减小的倍数大于c(CH3COO-)或c(H+)减小的倍数。在溶液中还存在水的大量平衡:H2O
CH3COO-+H+ A。若加入水,则c(CH3COO-)、c(CH3COOH)、c(H+)的浓度都减小。由于电离产生的离子的浓度减小的多,所以电离平衡正向移动。所以溶液中导电粒子的数目增加。正确。B。因此c(CH3COOH)减小的倍数大于c(CH3COO-)或c(H+)减小的倍数。在溶液中还存在水的大量平衡:H2O H++OH-。在溶液中存在水的离子积常数,它只与温度有关,而与浓度等无关。因此c(H+)·c(OH-)=Kw.c(H+)减小的倍数与c(OH-)增大的倍数相同。所以溶液中
H++OH-。在溶液中存在水的离子积常数,它只与温度有关,而与浓度等无关。因此c(H+)·c(OH-)=Kw.c(H+)减小的倍数与c(OH-)增大的倍数相同。所以溶液中 不变。正确。C.加水稀释,电离平衡正向移动,醋酸的电离程度增大,但由于温度不变,所以电离平衡常数Ka不变。正确。D.醋酸是弱酸部分电离。c(CH3COOH)>> c(H+)=10-3mol/L.若再加入10 mL pH=11的NaOH溶液,将电离的部分完全中和,由于在溶液中还存在电离未电离的电解质分子,所以破坏了醋酸的电离,平衡,醋酸会减小电离直至达到新的平衡。错误。
不变。正确。C.加水稀释,电离平衡正向移动,醋酸的电离程度增大,但由于温度不变,所以电离平衡常数Ka不变。正确。D.醋酸是弱酸部分电离。c(CH3COOH)>> c(H+)=10-3mol/L.若再加入10 mL pH=11的NaOH溶液,将电离的部分完全中和,由于在溶液中还存在电离未电离的电解质分子,所以破坏了醋酸的电离,平衡,醋酸会减小电离直至达到新的平衡。错误。
考点:考查在加水稀释的过程中弱电解质溶液的电离平衡、离子浓度、微粒的数目及电离平衡常数的知识。

锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
| A.CaCO3的溶解度小于CaSO4 |
| B.沉淀转化的实质是沉淀溶解平衡的移动 |
| C.沉淀转化的难易与溶解度差别的大小无关 |
| D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
已知CH3COOH CH3COO-+H+,下列关于醋酸说法错误的是
CH3COO-+H+,下列关于醋酸说法错误的是
| A.加水稀释,所有离子浓度都减少 |
| B.加入少量固体CH3COONa,平衡向逆方向移动,c(H+)减少 |
| C.升高温度促进了醋酸的电离,Ka增大。 |
| D.醋酸溶液的导电性不一定比盐酸要弱 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表,下列判断不正确的是
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) = Kw/10-9mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
下列叙述不正确的是
| A.CaCO3能够溶解在CO2的水溶液中 |
| B.Mg(OH)2可溶于盐酸,不溶于NH4Cl溶液 |
| C.AgCl可溶于氨水 |
| D.MgSO4溶液中滴加Ba(OH)2得到两种沉淀 |
下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
| A.①②③④ | B.①②③ |
| C.②③⑤ | D.全部 |
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏高的是( )
| A.酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
向10 mL 0.1 mol·L-1Na2CO3溶液中逐滴滴加V mL 0.1 mol·L-1HCl溶液,下列有关滴定过程中粒子浓度关系正确的是
A.当V=0时,c(OH-)=c(H+)+c(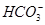 )+c(H2CO3) )+c(H2CO3) |
B.当V=5时,c(Na+)+c(H+)=2c( )+c( )+c(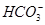 )+c(OH-) )+c(OH-) |
C.当V=10时,c(Cl-)=c( )+c( )+c(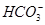 )+c(H2CO3) )+c(H2CO3) |
D.当V=15时,c(Na+)=c(Cl-)>c(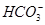 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |