题目内容
14.已知:
该合成氨反应的反应热为( )
| A. | +92 kJ/mol | B. | -92 kJ/mol | C. | -92 kJ | D. | +1081 kJ/mol |
分析 根据反应热=反应物的键能之和-生成物的键能之和进行计算.
解答 解:因为合成氨反应为N2+3H2?2NH3,又反应热=反应物的键能之和-生成物的键能之和,所以合成氨反应的反应热=436×3+946-391×6=-92kJ/mol,
故选:B.
点评 本题考查学生对反应热的计算,题目难度不大,注意掌握反应热=反应物的键能之和-生成物的键能之和.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.有机物具有广泛的用途.下列说法不正确的是( )
| A. | 能用于制作烈性炸药TNT的是甲苯 | |
| B. | 可用于杀菌消毒、制造阿司匹林的是苯酚 | |
| C. | 可用于食品调味剂的是乙酸 | |
| D. | 常用来焊接或切割金属的是苯 |
5.常温下,有①Na2CO3溶液、②NaHCO3溶液、③氨水、④NH4Cl溶液各25mL,其物质的量浓度均为0.1mol•L-1.关于上述四种溶液的说法正确的是( )
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)═c(NH3×H2O) | |
| D. | 向③、④中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):③<④ |
2.下列说法正确的是( )
| A. | 苯和苯乙烯是同系物 | |
| B. | 乙醇和乙醚是同分异构体 | |
| C. | 显酸性的有机化合物一定是羧酸 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,且都有同分异构体 |
19.下列各项与反应热的大小无关的是( )
| A. | 反应物和生成物的状态 | B. | 反应物量的多少 | ||
| C. | 反应的快慢 | D. | 反应物的性质 |
6. (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)△H<0.CO和H2O浓度变化如图,则 0-4min的平均反应速率v(CO)=0.03mol/(L•min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min-4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)△H<0.CO和H2O浓度变化如图,则 0-4min的平均反应速率v(CO)=0.03mol/(L•min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
3. 对可逆反应:A(气)+B(气)?2C(气)+Q,根据如图,从a反应历程改变为b反应历程,所采取的措施是( )
对可逆反应:A(气)+B(气)?2C(气)+Q,根据如图,从a反应历程改变为b反应历程,所采取的措施是( )
 对可逆反应:A(气)+B(气)?2C(气)+Q,根据如图,从a反应历程改变为b反应历程,所采取的措施是( )
对可逆反应:A(气)+B(气)?2C(气)+Q,根据如图,从a反应历程改变为b反应历程,所采取的措施是( )| A. | 增大B的浓度 | B. | 升高温度 | C. | 加入催化剂 | D. | 减小压强 |
4.下列含有离子键的物质是( )
| A. | HCl | B. | CO2 | C. | NaOH | D. | H2O |
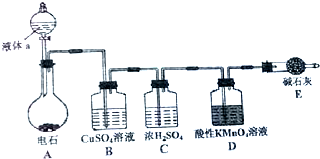 如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.
如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.