题目内容
7.下列关于电解质溶液的说法正确的是( )| A. | pH=3的NH4Cl溶液与pH=3的盐酸中,水电离的c(H+)相等 | |
| B. | 25℃时将0.1 mol•L-1的HF加水不断稀释,$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$减小 | |
| C. | K2SO3溶液中加入少量的Ba(OH)2固体,溶液的pH增大,SO${\;}_{3}^{2-}$水解程度减小 | |
| D. | 因为AgBr比AgCl的KSP小,所以AgCl可以转化为AgBr,但AgBr无法转化为AgCl |
分析 A、氯化铵是强酸弱碱盐能够水解促进水的电离,盐酸能够抑制水的电离;
B、HF的电离平衡常数K=$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$,其大小只受温度影响;
C、K2SO3溶液中加入少量的Ba(OH)2固体,反应生成BaSO3沉淀和KOH,pH增大,亚硫酸根离子浓度减小,水解程度减小;
D、沉淀转化为溶解度更小的物质容易发生.
解答 解:A、pH=3的NH4Cl溶液中水电离的c(H+)=10-3mol/L,pH=3的盐酸中,水电离的c(H+)=10-11mol/L,故A错误;
B、HF的电离平衡常数K=$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$,温度不变,其值不变,故B错误;
C、K2SO3溶液中加入少量的Ba(OH)2固体,反应生成BaSO3沉淀和KOH,pH增大,亚硫酸根离子浓度减小,水解程度减小,故C正确;
D、沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,但是在一定的浓度范围下,溴化银是可以转化为氯化银沉淀的,故D错误;
故选C.
点评 本题比较综合,是常见题型,涉及水的电离、沉淀转化、化学平衡常数等,难度不大,侧重对基础知识的考查.

练习册系列答案
相关题目
15.下列四项都能导电,其中一项与其他三项导电原理不同的是( )
| A. | 氯化钠熔化导电 | B. | 液态汞导电 | ||
| C. | H2SO4溶液导电 | D. | 熔融状态的K0H导电 |
19.下列反应的离子方程式,正确的是( )
| A. | Fe2O3溶于过量的氢酸碘中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+CO32- | |
| C. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
4.在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)?mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)m=2,表中b<c(填“<”、“=”或“>”).
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
5. 乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下:
乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下: +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$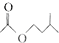 +H2O
+H2O
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:

(1)装置B的名称是:球形冷凝管
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后D(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在蒸馏操作中,如图2仪器选择及安装都正确的是:b(填标号)
(7)本实验的产率是:C
A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量的未反应的异戊醇.
 乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下:
乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下: +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙醇 | 60 | 1.0492 | 118 | 溶 |
| 乙醇异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:

(1)装置B的名称是:球形冷凝管
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后D(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在蒸馏操作中,如图2仪器选择及安装都正确的是:b(填标号)
(7)本实验的产率是:C
A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量的未反应的异戊醇.


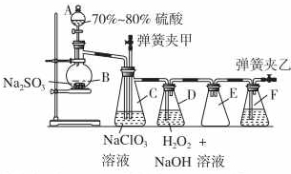 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.