题目内容
如图,氢氧燃料电池已用于宇宙飞船及潜水艇中,其电极反应为:负极:2H2-4e-+4OH-=4H2O 正极:O2+2H2O+4e-=4OH-所产生的水可作为饮用水,今欲得常温下1L这样的水,则电池内转移电子的物质的量大约是______mol.

1L水的质量为1000g,水的物质的量为n=
=
=
mol
负极:2H2-4e-+4OH-=4H2O ①
正极:O2+2H2O+4e-=4OH-②
①+②得:2H2+O2=2H2O 转移电子
2mol 4mol
mol 111.11mol
故答案为:111.11.
| m |
| M |
| 1000g |
| 18g/mol |
| 500 |
| 9 |
负极:2H2-4e-+4OH-=4H2O ①
正极:O2+2H2O+4e-=4OH-②
①+②得:2H2+O2=2H2O 转移电子
2mol 4mol
| 500 |
| 9 |
故答案为:111.11.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
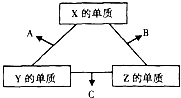 X、Y、Z三种短周期元素,它们的原子序数之和为16.在常温下,X、Y、Z三种元素的常见单质都是无色气体,它们在适当条件下可发生如图所示的转化.已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,它们的原子序数之和为16.在常温下,X、Y、Z三种元素的常见单质都是无色气体,它们在适当条件下可发生如图所示的转化.已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数少一个.请回答下列问题: 如图,氢氧燃料电池已用于宇宙飞船及潜水艇中,其电极反应为:负极:2H2-4e-+4OH-=4H2O 正极:O2+2H2O+4e-=4OH-所产生的水可作为饮用水,今欲得常温下1L这样的水,则电池内转移电子的物质的量大约是
如图,氢氧燃料电池已用于宇宙飞船及潜水艇中,其电极反应为:负极:2H2-4e-+4OH-=4H2O 正极:O2+2H2O+4e-=4OH-所产生的水可作为饮用水,今欲得常温下1L这样的水,则电池内转移电子的物质的量大约是
